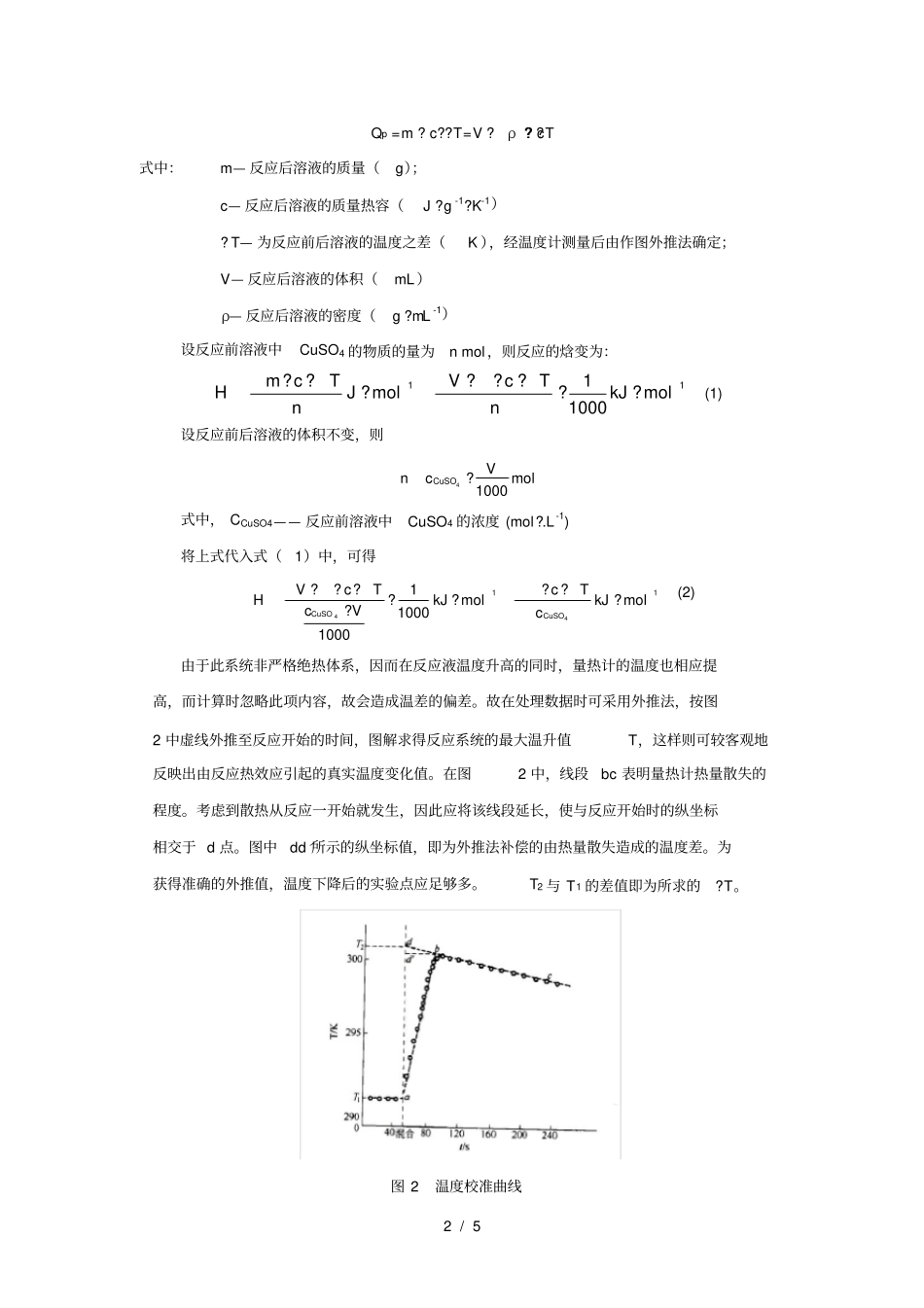
1 / 5 实验 1 化学反应摩尔焓变的测定一. 实验目的1. 了解测定化学反应摩尔焓变的原理和方法;2. 学习物质称量、溶液配制和溶液移取等基本操作;3. 学习外推法处理实验数据的原理和方法。二. 背景知识及实验原理化学反应过程中,除物质发生变化外,还伴有能量变化。这种能量变化通常表现为化学反应的热效应(简称为化学反应热)。化学反应通常是在等温、等压、不做非体积功的条件下进行的,此时反应热效应亦称作等压热效应,用Qp 表示。化学反应的等压热效应(Qp)在数值上等于化学反应的摩尔反应焓变(△ rHm)(热力学规定放热反应为负值,吸热反应为正值)。在标准状态下,化学反应的摩尔反应焓变称为化学反应的标准摩尔焓变,用△rHmθ表示。化学反应焓变或化学反应热效应的测定原理是:在绝热条件下 (反应系统不与量热计外的环境发生热量交换) ,使反应物仅在量热计中发生反应,并使量热计及其内物质的温度发生改变。 通过反应系统在反应前后的温度变化,以及有关物质的质量和比热,可以计算出反应的热效应值。实验中溶液反应的焓变值测定采用如图1 所示的简易量热计进行测定,通过测定 CuSO4溶液与 Zn 粉的反应进行焓变值的获取。图 1 保温杯式量热计CuSO4 溶液与 Zn 粉的反应式为:Cu2+(aq) + Zn( s) = Cu( s) + Zn 2+(aq) 由于该反应速率较快,且能进行得相当完全。实验中若使用过量Zn 粉,则 CuSO4 溶液中 Cu2+可认为完全转化为Cu。系统中反应放出的热量等于溶液所吸收的热量。在简易量热计中,反应后溶液所吸收的热量为:2 / 5 Qp =m ? c??T=V ? ρ ? c? ?T式中:m— 反应后溶液的质量(g);c— 反应后溶液的质量热容(J ? g -1?K-1)? T— 为反应前后溶液的温度之差(K ),经温度计测量后由作图外推法确定;V— 反应后溶液的体积(mL)ρ— 反应后溶液的密度(g ?mL-1)设反应前溶液中CuSO4 的物质的量为n mol ,则反应的焓变为:1110001????????molkJnTcVmolJnTcmH(1) 设反应前后溶液的体积不变,则molVcnCuSO10004 ?式中, CCuSO4—— 反应前溶液中CuSO4 的浓度 (mol?.L-1) 将上式代入式(1)中,可得1144100011000?????????molkJcTcmolkJVcTcVHCuSOCuSO(2) 由于此系统非严格绝热体系,因而在反应液温度升高的同时,量热计的温度也相应提高,而计算时忽略此项内容,故会造成温差的偏差。故在处理数据时可采用外推法,按图2 中虚线外推至反应开始的时间...