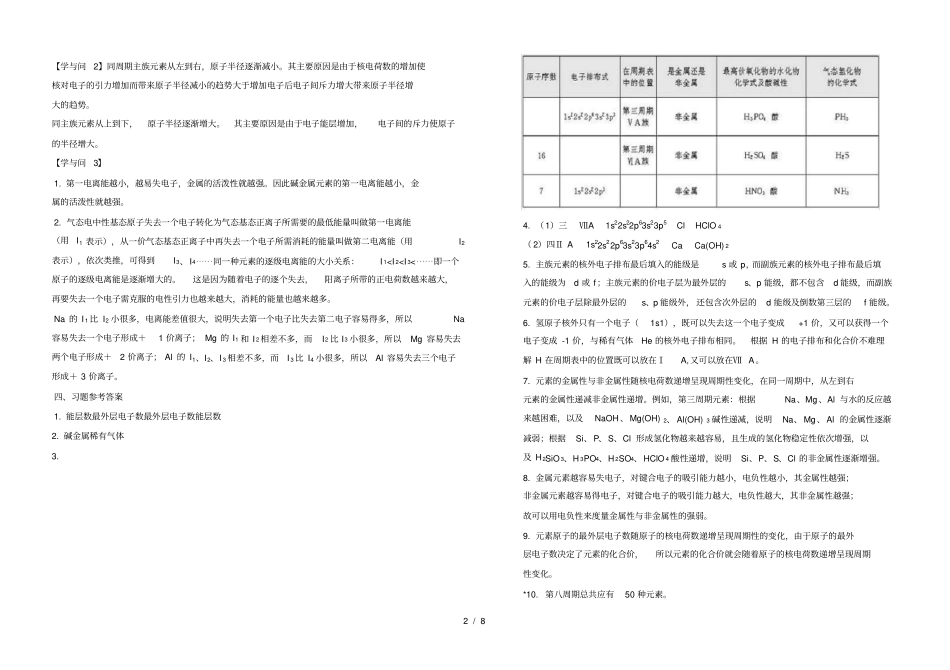
1 / 8 第一节 原子结构【科学探究】 1. 每个原子轨道里最多只能容纳2 个电子。2. 当电子排布在同一能级时,总是优先单独占据不同的轨道而且自旋方向相同。【学与问】1. 原子核外电子的每一个能层最多可容纳的电子数为2n2。2. 每个能层所具有的能级数等于能层的序数(n)。3. 英文字母相同的不同能级中所容纳的最多电子数相同。【思考与交流】1. 铜、银、金的外围电子排布不符合构造原理。2. 符号[ Ne]表示 Na 的内层电子排布与稀有气体元素Ne 的核外电子排布相同。O:[ He]2s22p4 Si:[ Ne]3s23p2 Fe:[ Ne]3s23p63d64s2 或[ Ar ]3d64s2四、习题参考答案1. A 、D 2. D 3. B 4. C 5. C 6. C 是 Mg 的基态原子的电子排布式,而A、B、D 都不是基态原子的电子排布。7. 8.第二节原子结构与元素的性质【科学探究1】 1. 元素周期表共有7 个周期,每个周期包括的元素数目分别为:第一周期2 种;第二周期 8 种;第三周期8 种;第四周期18 种;第五周期18 种;第六周期32 种;第七周期为不完全周期。每个周期开头第一个元素的最外层电子的排布通式为ns1,结尾元素的最外层电子的排布通式为ns2np6。因为第一周期元素只有一个1s 能级,其结尾元素的电子排布式为 1s2,跟其他周期的结尾元素的电子排布式不同。2. 元素周期表共有18 个纵列;每个纵列的价电子层的电子总数相等。3. s 区有 2 个纵列, d 区有 8 个纵列, p 区有 6 个纵列;从元素的价电子层结构可以看出,s 区、 d 区和 ds 区的元素在发生化学反应时容易失去最外层电子及倒数第二层的d 电子,呈现金属性,所以s 区、 d 区和 ds 区的元素都是金属。4. 元素周期表可分为主族、副族和0 族;从教科书中图1-16 可知,副族元素(包括d 区和 ds 区的元素)介于s 区元素(主要是金属元素)和p 区(主要是非金属元素)之间,处于由金属元素向非金属元素过渡的区域,因此,把副族元素又称为过渡元素。5. 这是由元素的价电子层结构和元素周期表中元素性质递变规律决定的,在元素周期表中, 同周期元素从左到右非金属性逐渐增强,金属性逐渐减弱,同主族元素从上到下非金属性逐渐减弱, 金属性逐渐增强,结果使元素周期表右上角三角区域内的元素主要呈现出非金属性。6. 由于元素的金属性和非金属性之间并没有严格的界线,处于非金属三角区边缘的元素既能表现出一定的非金属性,又能表现出一定的金属性,...