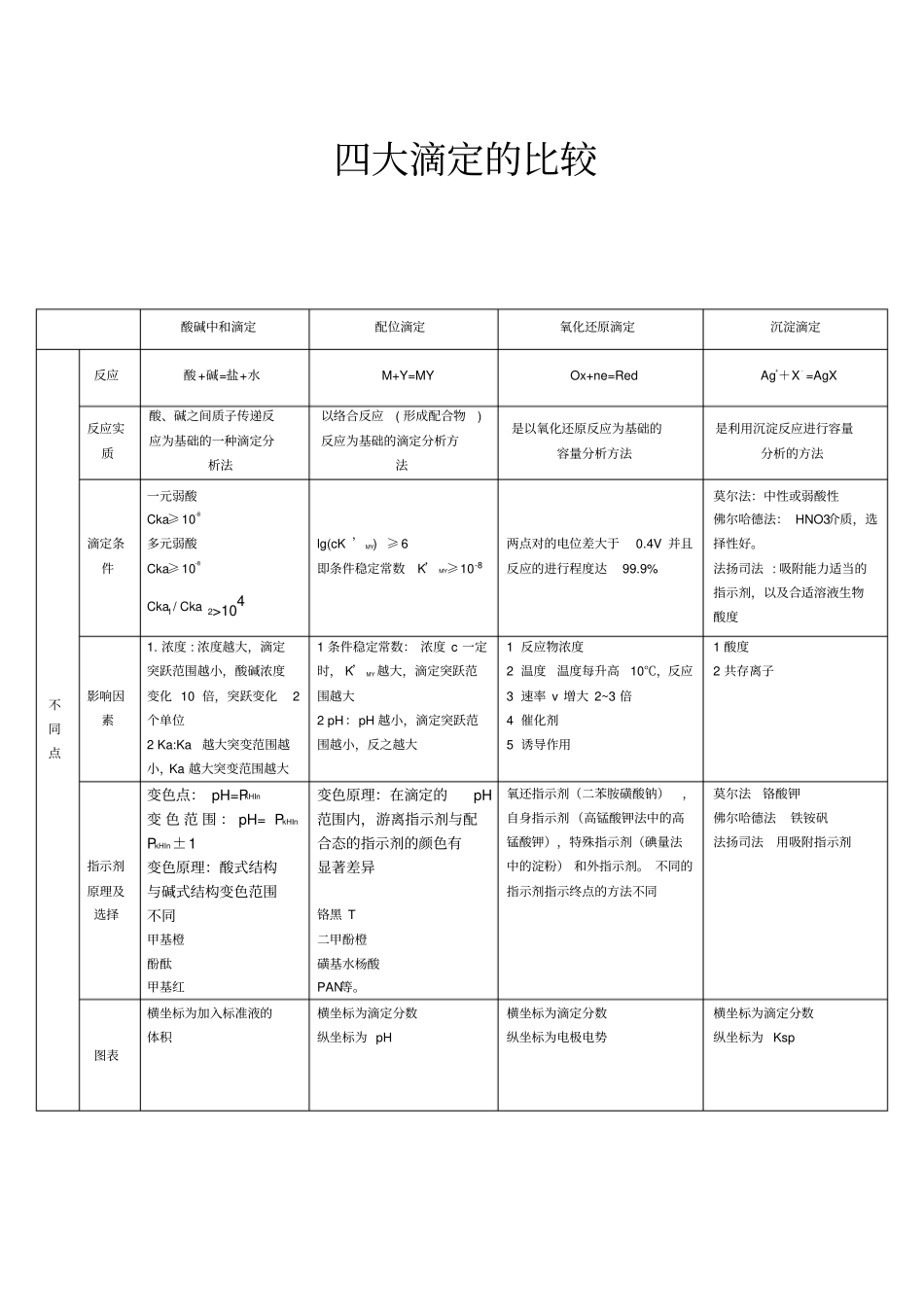
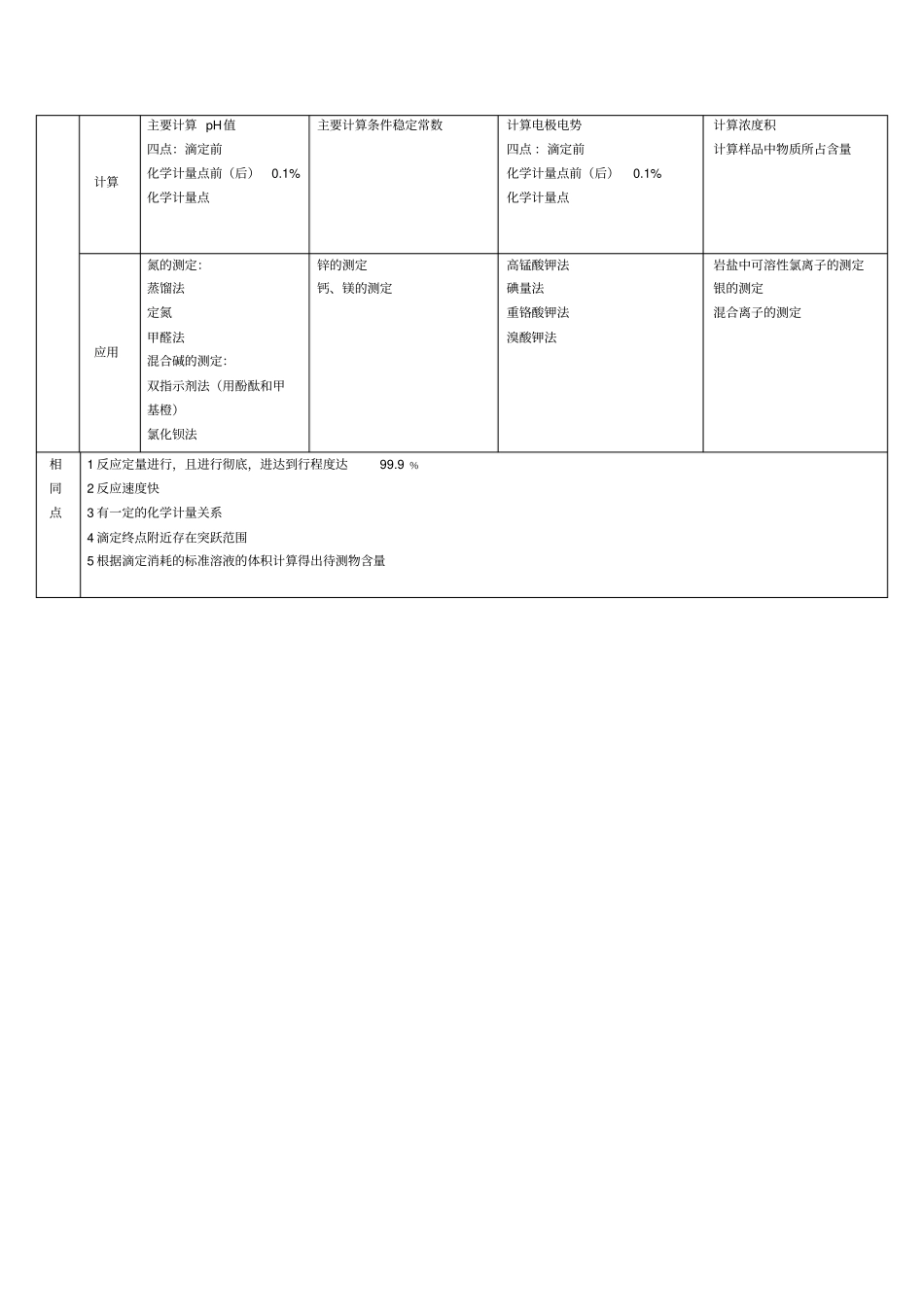
四大滴定的比较酸碱中和滴定配位滴定氧化还原滴定沉淀滴定不同点反应酸 +碱=盐+水M+Y=MY Ox+ne=Red Ag++X﹣=AgX反应实质酸、碱之间质子传递反应为基础的一种滴定分析法以络合反应( 形成配合物)反应为基础的滴定分析方法是以氧化还原反应为基础的容量分析方法是利用沉淀反应进行容量分析的方法滴定条件一元弱酸Cka≥ 10-8多元弱酸Cka≥ 10-8Cka1/ Cka 2>104lg(cK ’ MY) ≥ 6 即条件稳定常数K’ MY≥10-8两点对的电位差大于0.4V 并且反应的进行程度达99.9% 莫尔法:中性或弱酸性佛尔哈德法: HNO3介质,选择性好。法扬司法 : 吸附能力适当的指示剂,以及合适溶液生物酸度影响因素1. 浓度 : 浓度越大,滴定突跃范围越小,酸碱浓度变化 10 倍,突跃变化2个单位2 Ka:Ka越大突变范围越小,Ka 越大突变范围越大1 条件稳定常数: 浓度 c 一定时, K’ MY 越大,滴定突跃范围越大2 pH:pH 越小,滴定突跃范围越小,反之越大1 反应物浓度2 温度温度每升高10℃,反应3 速率 v 增大 2~3 倍4 催化剂5 诱导作用1 酸度2 共存离子指示剂原理及选择变色点: pH=PkHIn 变 色 范 围 : pH= PkHInPkHIn±1 变色原理:酸式结构与碱式结构变色范围不同甲基橙酚酞甲基红变色原理:在滴定的pH范围内,游离指示剂与配合态的指示剂的颜色有显著差异铬黑 T 二甲酚橙磺基水杨酸PAN等。氧还指示剂(二苯胺磺酸钠),自身指示剂 (高锰酸钾法中的高锰酸钾),特殊指示剂(碘量法中的淀粉) 和外指示剂。 不同的指示剂指示终点的方法不同莫尔法铬酸钾佛尔哈德法铁铵矾法扬司法用吸附指示剂图表横坐标为加入标准液的体积横坐标为滴定分数纵坐标为 pH 横坐标为滴定分数纵坐标为电极电势横坐标为滴定分数纵坐标为 Ksp 计算主要计算 pH值四点:滴定前化学计量点前(后)0.1% 化学计量点主要计算条件稳定常数计算电极电势四点 :滴定前化学计量点前(后)0.1% 化学计量点计算浓度积计算样品中物质所占含量应用氮的测定:蒸馏法定氮甲醛法混合碱的测定:双指示剂法(用酚酞和甲基橙)氯化钡法锌的测定钙、镁的测定高锰酸钾法碘量法重铬酸钾法溴酸钾法岩盐中可溶性氯离子的测定银的测定混合离子的测定相同点1 反应定量进行,且进行彻底,进达到行程度达99.9 ﹪2 反应速度快3 有一定的化学计量关系4 滴定终点附近存在突跃范围5 根据滴定消耗的标准溶液的体积计算得出待测物含量