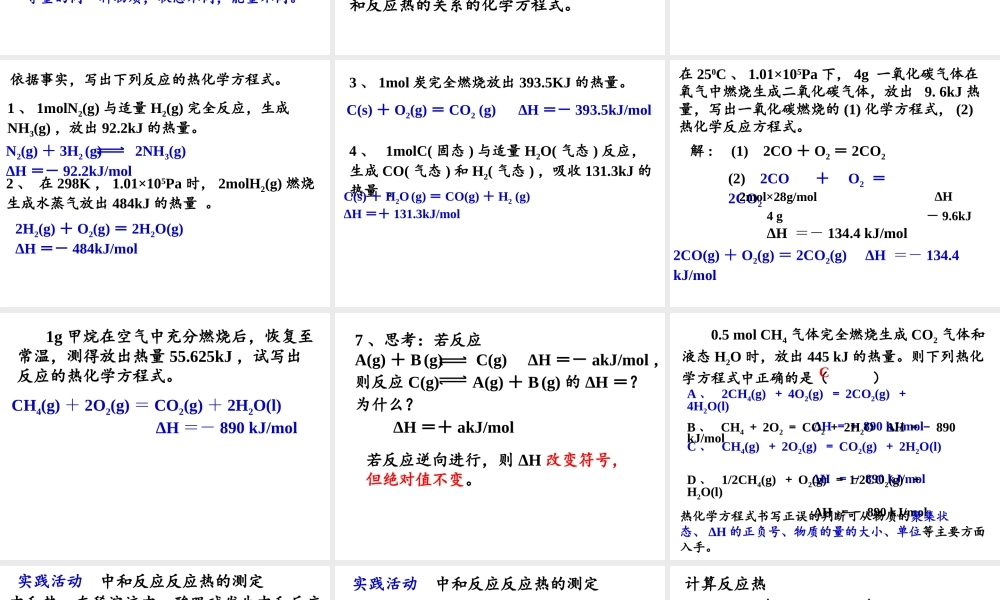
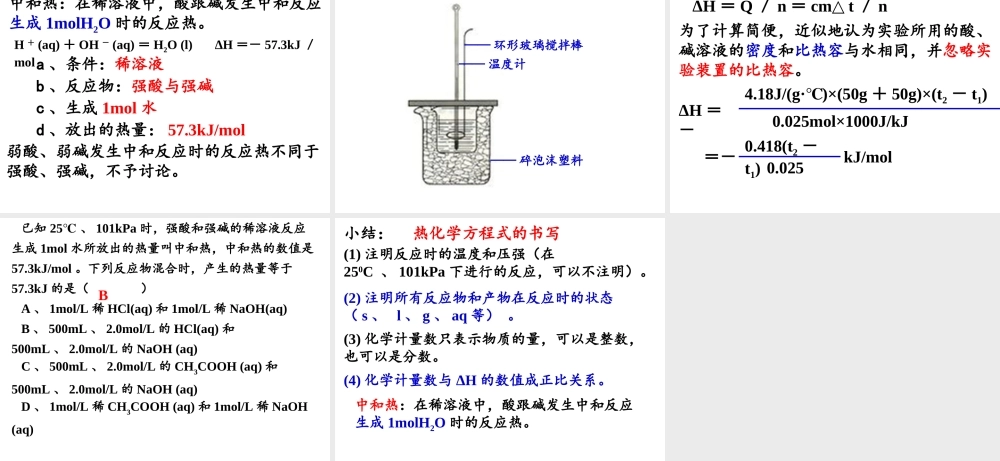
第一节 化学反应与能量的变化 第一章 化学反应与能量(第二课时) 学习目标:1 、掌握热化学方程式的书写方法。2 、了解热化学方程式的涵义。3 、掌握中和热的测定方法。学习重点、难点:热化学方程式的书写。ΔH =生成物总能量-反应物总能量ΔH =反应物键能之和-生成物键能之和放热反应:吸热反应:反应后体系能量降低,ΔH < 0 或 ΔH 为“-”。反应后体系能量升高,ΔH > 0 或 ΔH 为“+”。二、热化学方程式H2(g) + I2(g) 2HI(g) ΔH =- 14.9 kJ/mol200℃101kPaH2 + I2 = 2HI(2) 所有的反应物和产物都用括号注明它们在反应时的状态( s 、 l 、 g 、 aq 等);(3) 在方程式右端标出能量的符号和数值,吸热用“+”,放热用“-”。(1) 注明了反应时的温度和压强;在 250C 、 101kPa 下进行的反应,可以不注明反应时的温度和压强;为什么所有的反应物和产物都用括号注明它们在反应时的状态( s 、 l 、 g 、 aq 等)?H2(g) + O2(g) = H2O(g) ΔH =-241.8kJ/mol12H2(g) + O2(g) = H2O(l) ΔH =-285.8kJ/mol12等量的同一种物质,状态不同,能量不同。2H2(g) + O2(g) = 2H2O(l) ΔH =-571.6kJ/molH2(g) + O2(g) = H2O(l) ΔH =-285.8kJ/mol12热化学方程式中的化学计量数只表示物质的量,化学计量数与 ΔH 的数值成正比关系。化学计量数可以是整数,也可以是分数。热化学方程式:能表示参加反应物质的量和反应热的关系的化学方程式。书写热化学方程式的注意事项:(1) 注明反应时的温度和压强(在250C 、 101kPa 下进行的反应,可以不注明)。(2) 注明所有反应物和产物在反应时的状态( s 、 l 、 g 、 aq 等) 。(3) 化学计量数只表示物质的量,可以是整数,也可以是分数。(4) 化学计量数与 ΔH 的数值成正比关系。依据事实,写出下列反应的热化学方程式。1 、 1molN2(g) 与适量 H2(g) 完全反应,生成NH3(g) ,放出 92.2kJ 的热量。2 、 在 298K , 1.01×105Pa 时, 2molH2(g) 燃烧生成水蒸气放出 484kJ 的热量 。2H2(g) + O2(g) = 2H2O(g) ΔH =- 484kJ/molN2(g) + 3H2 (g) 2NH3(g) ΔH =- 92.2kJ/mol 3 、 1mol 炭完全燃烧放出 393.5KJ 的热量。C(s) + O2(g) = CO2 (g) ΔH =- 393.5kJ/mol4 、 1molC( 固态 ) 与适量 H2O( 气态 ) 反应,...