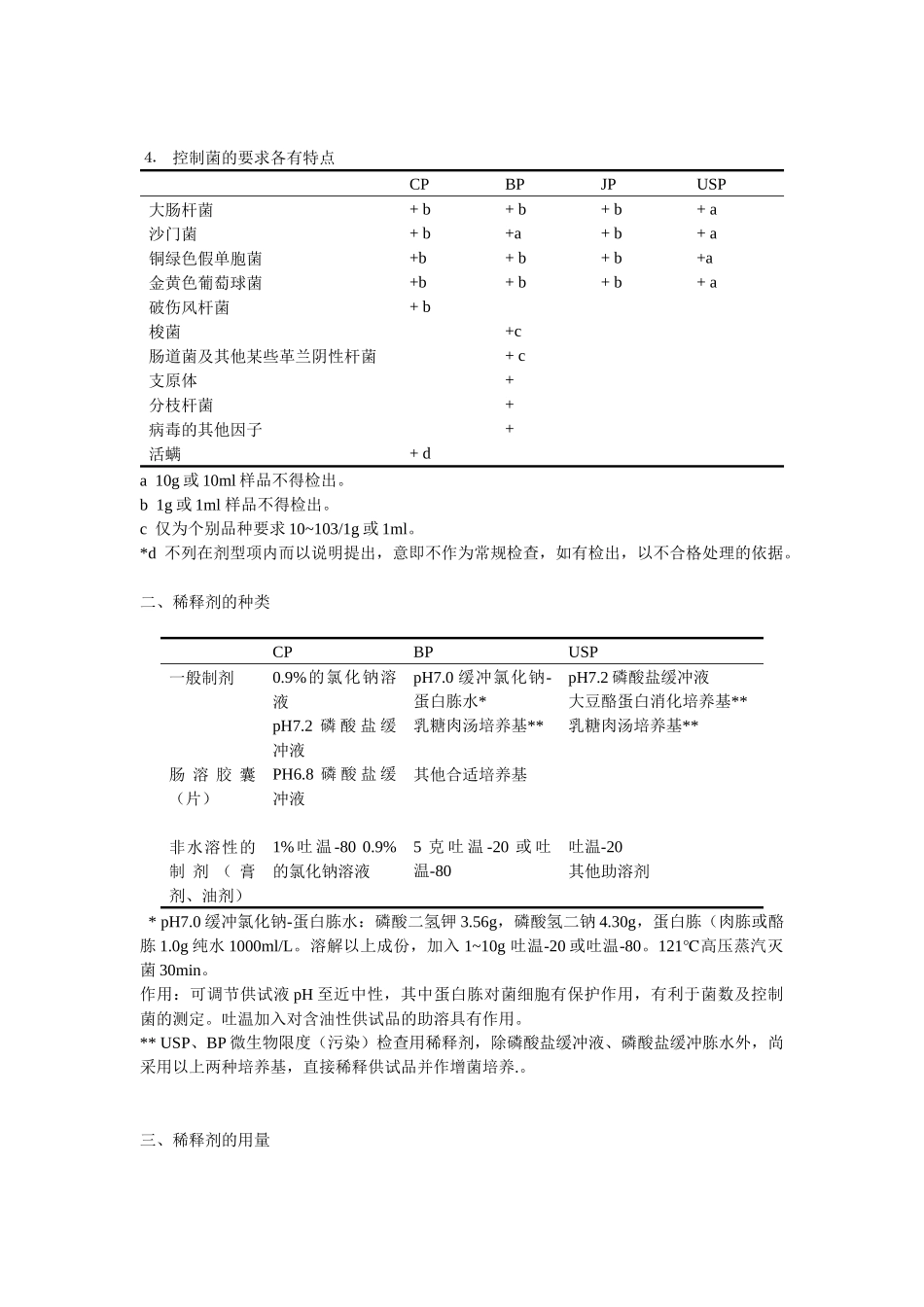
四国药典有关药品微生物限度标准的比较[日期:2005-2-21]来源: 作者:胡敏[1] 胡昌勤* 刘文英 2[ 字 体 : 大 中 小] 四国药典有关药品微生物限度标准的比较微生物限度规定的作用,是为药品生产提供一个标准或指导,以确保药品使用的安全。各国药典标准分为强制性的和非强制性的可达到的限度标准,这些指标正确、有效地规范了药品生产、检定和监督的程序。药品要能反映不引起生物降解物和没有药源性污染的微生物存在是必要的,严格控制条件致病菌及致病菌。一、CP、USP、BP、JP 的微生物限度要求的特点及其发展趋势⒈ 各国药典收载微生物限度检查法的时间不同(见表 1)表 1 各国药典收载微生物限度检查法的时间各国药典CPUSPBPJP收 载 微 生 物 限 度检查法的时间1995 版*1975 ( 19)1973---方法1988---品种**第十三改正版*** *1978 年颁布第一个药品卫生标准;1986 年颁布了修改的药品卫生标准;1989 年下发药 品卫生标准补充规定和说明 1995 年版中国药典收载微生物限度检查法(标准仅为少数剂型) **品种 98 版 43 个,其中原料药品种 38 个,制剂品种仅 5 个。 ***仅有 6 个品种。⒉ 品种不断扩大USP 版本(年代)19(1975)22(1990)23(1995)24(2000)微生物限度品种数35140150217* *217 种包括原料药品种 72 个(占 1/3);制剂品种(占 2/3)。⒊ 活菌数要求各有特点活 菌 数 ( 个 /1g 或1ml)CPBPJPUSP需气菌102~3×104102~107102~10310~104真菌0~102102~1055×10~5×10210~103⒋ 控制菌的要求各有特点CPBPJPUSP大肠杆菌+ b + b + b + a 沙门菌+ b +a+ b + a 铜绿色假单胞菌+b+ b + b +a金黄色葡萄球菌+b+ b + b + a破伤风杆菌+ b 梭菌+c肠道菌及其他某些革兰阴性杆菌+ c 支原体+分枝杆菌+病毒的其他因子+活螨+ d a 10g 或 10ml 样品不得检出。b 1g 或 1ml 样品不得检出。c 仅为个别品种要求 10~103/1g 或 1ml。*d 不列在剂型项内而以说明提出,意即不作为常规检查,如有检出,以不合格处理的依据。二、稀释剂的种类CPBPUSP一般制剂0.9%的氯化钠溶液pH7.2 磷 酸 盐 缓冲液pH7.0 缓冲氯化钠-蛋白胨水*乳糖肉汤培养基**其他合适培养基pH7.2 磷酸盐缓冲液大豆酪蛋白消化培养基**乳糖肉汤培养基**肠 溶 胶 囊(片)PH6.8 磷 酸 盐 缓冲液非水溶性的制 剂 ( 膏剂、油剂)1% 吐 温 -80 0.9%的氯化钠溶液5 ...