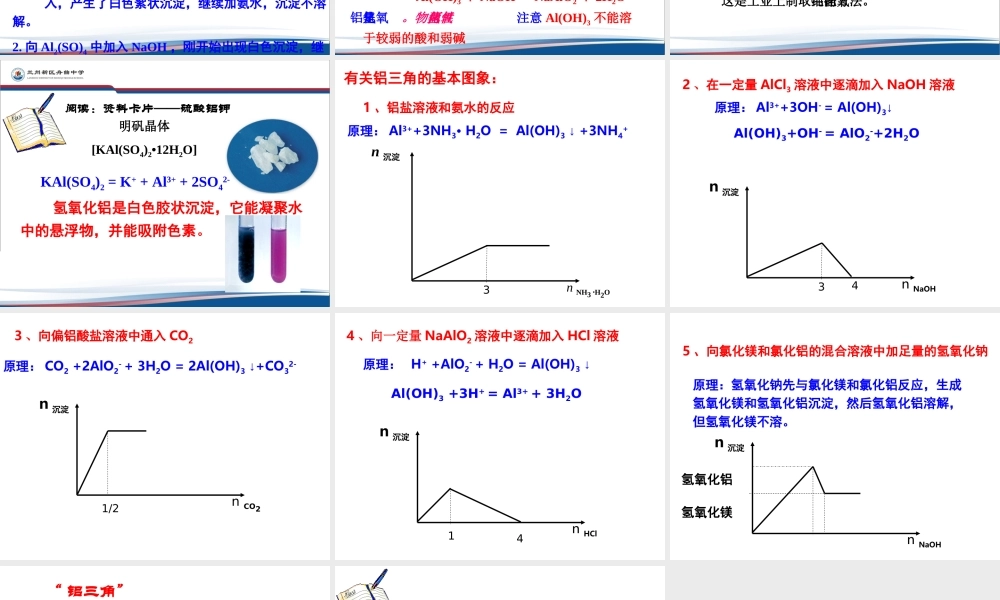
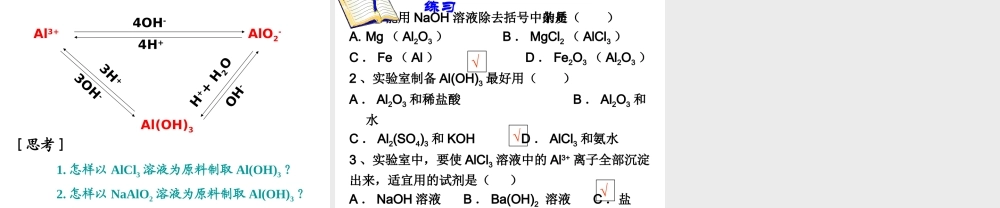
第二节 几种重要的金属化合物3-2-3 、铝的重要化合物 铝是地壳中含量最多的金属元素,在生活中铝制品广泛多见。思考:铝是活泼金属,但为什么铝制品得到广泛使用呢? 思考:Na 和 Al 都是活泼的金属,它们的氧化物 Na2O 、Al2O3 性质类似吗? Al2O3 有什么特别的性质?Al2O3 难溶于水,熔点很高,也很坚固;是冶炼金属铝的原料,也是一种比较好的耐火材料。氧化铝物理性质二、铝的重要化合物 铝能与强酸、强碱反应,那么 Al2O3 能否也 溶于强酸和强碱呢? 请思考氧化铝难溶于水,却能溶于酸或强碱溶液中。• Al2O3 + 6HCl = 2AlCl3 + 3H2O• Al2O3 + 6H+ = Al3+ + 3H2O• Al2O3 + 2NaOH = 2NaAlO2 + H2O• Al2O3 + 2OH- = 2AlO2 - + H2O结论: Al2O3 是一种两性氧化物。氧化铝化学性质:讨论:桌面上有两堆白色粉末,分别为 Al2O3 、MgO, 你能用什么方法加以鉴别? 2 、氢氧化铝[Al(OH)3]【实验 3-7 】1. 在试管里加入 10 mL 0.5mol/L Al2(SO)4 溶液,加入氨水,生成白色胶状物质。继续滴加氨水,直到不在产生沉淀为止。2. 向盛有少量 Al2(SO)4 溶液的小试管中逐滴加入 2mol/L NaOH 溶液。Al(OH)3 的制备现象: 1. 向 Al2(SO)4 中加入氨水时,随着氨水的加 入,产生了白色絮状沉淀,继续加氨水,沉淀不溶解。2. 向 Al2(SO)4 中加入 NaOH ,刚开始出现白色沉淀,继续加入 NaOH ,沉淀溶解。 AlCl3 + 3NH 3·H2O = Al(OH)3 + 3NH4Cl1) 制备【 实验 3-8 】 2 ) Al(OH)3 的化学性质取新制取的氢氧化铝分别与2mol/L 盐酸和氢氧化钠溶液反应。观察现象。【实验现象】加入盐酸和 NaOH 后沉淀都溶解。与强酸反应 Al(OH)3+ 3HCl = AlCl3+ 3H2O与强碱反应 Al(OH)3 + NaOH = NaAlO2 + 2H2O氢氧化铝是两性氢氧化物。注意 Al(OH)3 不能溶于较弱的酸和弱碱 Al(OH)3 是医用的胃酸中和剂中的一种,它的碱性不强,不至于对胃壁产生强烈的刺激或腐蚀作用,但却可以与酸反应,使胃液酸度降低,起到中和过多胃酸的作用。3) 不稳定性:氢氧化铝不稳定,受热易分解。 ∆2Al(OH)3 = Al2O3 + 3H2O这是工业上制取纯净氧化铝的方法。 阅读:资料卡片——硫酸铝钾明矾晶体[KAl(SO4)2•12H2O] 氢氧化铝是白色胶状沉淀,它能凝聚水中的悬浮物,并能吸附色素。KAl(SO4)2 = K+ + Al3+ + 2SO42- 有关铝三角的基本图象:1 、铝盐...