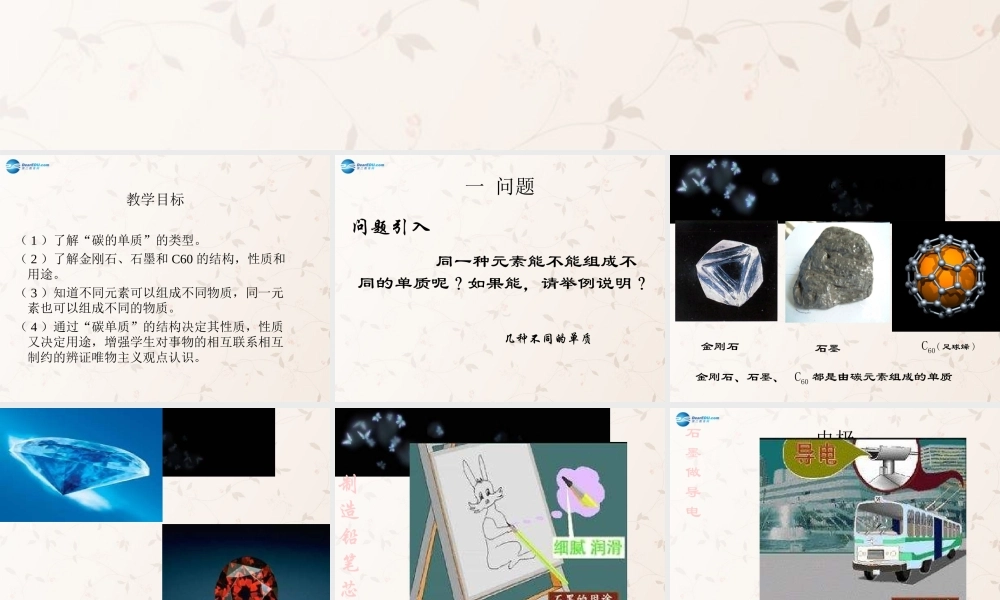
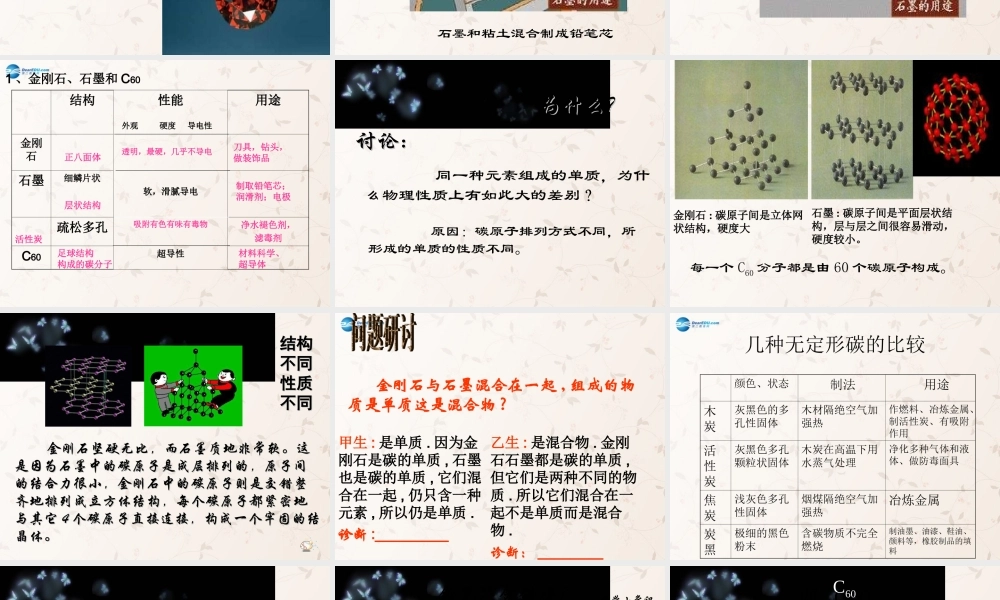
金刚石、石墨和 C60教学目标( 1 )了解“碳的单质”的类型。( 2 )了解金刚石、石墨和 C60 的结构,性质和用途。( 3 )知道不同元素可以组成不同物质,同一元素也可以组成不同的物质。( 4 )通过“碳单质”的结构决定其性质,性质又决定用途,增强学生对事物的相互联系相互制约的辨证唯物主义观点认识。一 问题问题引入 同一种元素能不能组成不同的单质呢?如果能,请举例说明? 几种不同的单质几种不同的单质金刚石石墨金刚石、石墨、 C60 都是由碳元素组成的单质C60( 足球烯 )1制造铅笔芯石墨和粘土混合制成铅笔芯电极石墨做导电结构性能用途金刚石石墨细鳞片状软,滑腻导电疏松多孔吸附有色有味有毒物净水褪色剂,滤毒剂C60超导性1 、金刚石、石墨和 C60正八面体刀具,钻头,做装饰品层状结构制取铅笔芯;润滑剂;电极足球结构构成的碳分子材料科学、超导体外观硬度导电性透明,最硬,几乎不导电活性炭为什么 为什么?为什么? 同一种元素组成的单质,为什么物理性质上有如此大的差别? 原因:碳原子排列方式不同,所形成的单质的性质不同。讨论讨论::金刚石 : 碳原子间是立体网状结构,硬度大石墨 : 碳原子间是平面层状结构,层与层之间很容易滑动,硬度较小。每一个 C60 分子都是由 60 个碳原子构成。原因 金刚石坚硬无比,而石墨质地非常软。这金刚石坚硬无比,而石墨质地非常软。这是因为石墨中的碳原子是成层排列的,原子间是因为石墨中的碳原子是成层排列的,原子间的结合力很小,金刚石中的碳原子则是交错整的结合力很小,金刚石中的碳原子则是交错整齐地排列成立方体结构,每个碳原子都紧密地齐地排列成立方体结构,每个碳原子都紧密地与其它与其它 44 个碳原子直接连接,构成一个牢固的结个碳原子直接连接,构成一个牢固的结晶体。 晶体。 结构结构不同不同性质性质不同不同 金刚石与石墨混合在一起 , 组成的物质是单质这是混合物 ?甲生 : 是单质 . 因为金刚石是碳的单质 , 石墨也是碳的单质 , 它们混合在一起 , 仍只含一种元素 , 所以仍是单质 .诊断 :_________乙生 : 是混合物 . 金刚石石墨都是碳的单质 ,但它们是两种不同的物质 . 所以它们混合在一起不是单质而是混合物 .诊断: ________几种无定形碳的比较颜色、状态 制法 用途木炭灰黑色的多孔性固体木材隔绝空气加强热作燃料、冶炼金属、制活性炭、有吸附作用活性炭灰黑色多孔颗粒状固体木炭在高温下用...