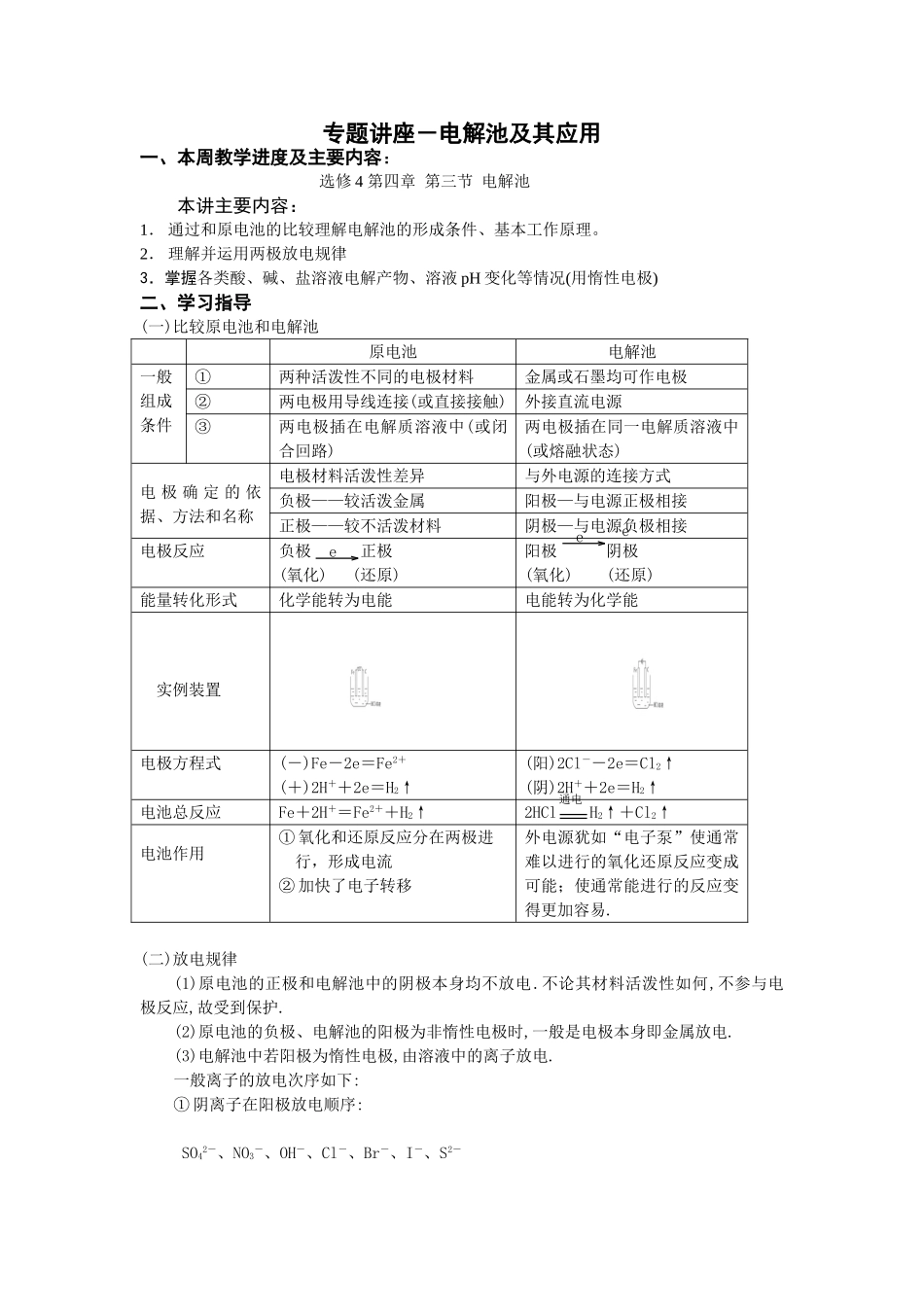
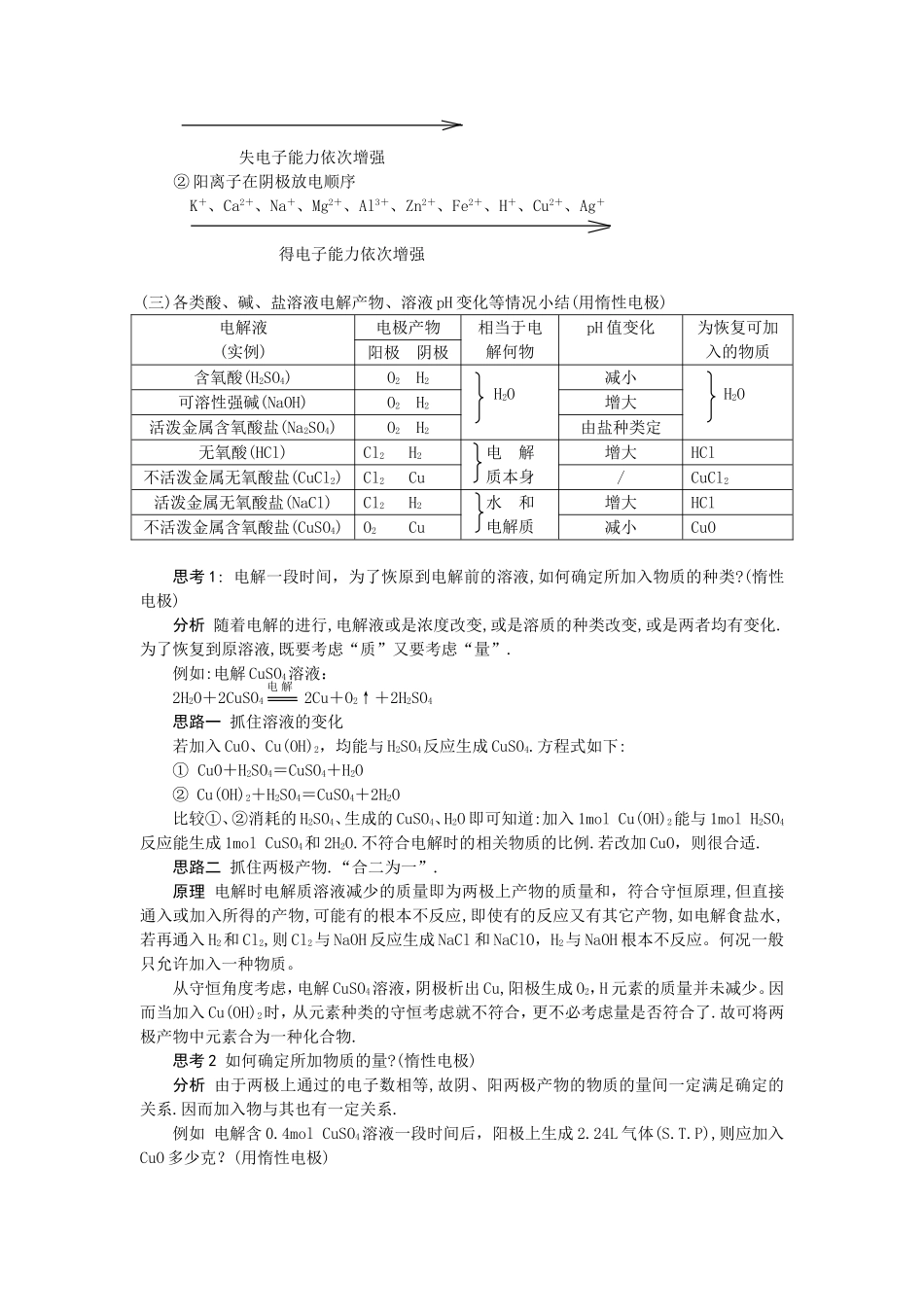
专题讲座-电解池及其应用一、本周教学进度及主要内容:选修 4 第四章 第三节 电解池本讲主要内容:1. 通过和原电池的比较理解电解池的形成条件、基本工作原理。2. 理解并运用两极放电规律3.掌握各类酸、碱、盐溶液电解产物、溶液 pH 变化等情况(用惰性电极)二、学习指导(一)比较原电池和电解池原电池电解池一般组成条件①两种活泼性不同的电极材料金属或石墨均可作电极②两电极用导线连接(或直接接触)外接直流电源③两电极插在电解质溶液中(或闭合回路)两电极插在同一电解质溶液中(或熔融状态)电 极 确 定 的 依据、方法和名称电极材料活泼性差异与外电源的连接方式负极——较活泼金属阳极—与电源正极相接正极——较不活泼材料阴极—与电源负极相接电极反应负极 正极(氧化) (还原) 阳极 阴极(氧化) (还原)能量转化形式化学能转为电能电能转为化学能 实例装置电极方程式(-)Fe-2e=Fe2+(+)2H++2e=H2↑(阳)2Cl--2e=Cl2↑(阴)2H++2e=H2↑电池总反应Fe+2H+=Fe2++H2↑2HCl H2↑+Cl2↑电池作用① 氧化和还原反应分在两极进 行,形成电流② 加快了电子转移外电源犹如“电子泵”使通常难以进行的氧化还原反应变成可能;使通常能进行的反应变得更加容易.(二)放电规律(1)原电池的正极和电解池中的阴极本身均不放电.不论其材料活泼性如何,不参与电极反应,故受到保护.(2)原电池的负极、电解池的阳极为非惰性电极时,一般是电极本身即金属放电.(3)电解池中若阳极为惰性电极,由溶液中的离子放电.一般离子的放电次序如下:① 阴离子在阳极放电顺序: SO42-、NO3-、OH-、Cl-、Br-、I-、S2-通电eee 失电子能力依次增强② 阳离子在阴极放电顺序 K+、Ca2+、Na+、Mg2+、Al3+、Zn2+、Fe2+、H+、Cu2+、Ag+ 得电子能力依次增强(三)各类酸、碱、盐溶液电解产物、溶液 pH 变化等情况小结(用惰性电极)电解液(实例)电极产物相当于电解何物pH 值变化为恢复可加入的物质阳极 阴极含氧酸(H2SO4)O2 H2 H2O减小 H2O可溶性强碱(NaOH)O2 H2增大活泼金属含氧酸盐(Na2SO4)O2 H2由盐种类定无氧酸(HCl)Cl2 H2 电 解 质本身增大HCl不活泼金属无氧酸盐(CuCl2)Cl2 Cu/CuCl2活泼金属无氧酸盐(NaCl)Cl2 H2 水 和 电解质增大HCl不活泼金属含氧酸盐(CuSO4)O2 Cu减小CuO思考 1: 电解一段时间,为了恢原到电解前的溶液,如何确定所加入物质的种类?(惰性电极)分析 随着电解的进行,电解液或是浓度改变,或是...