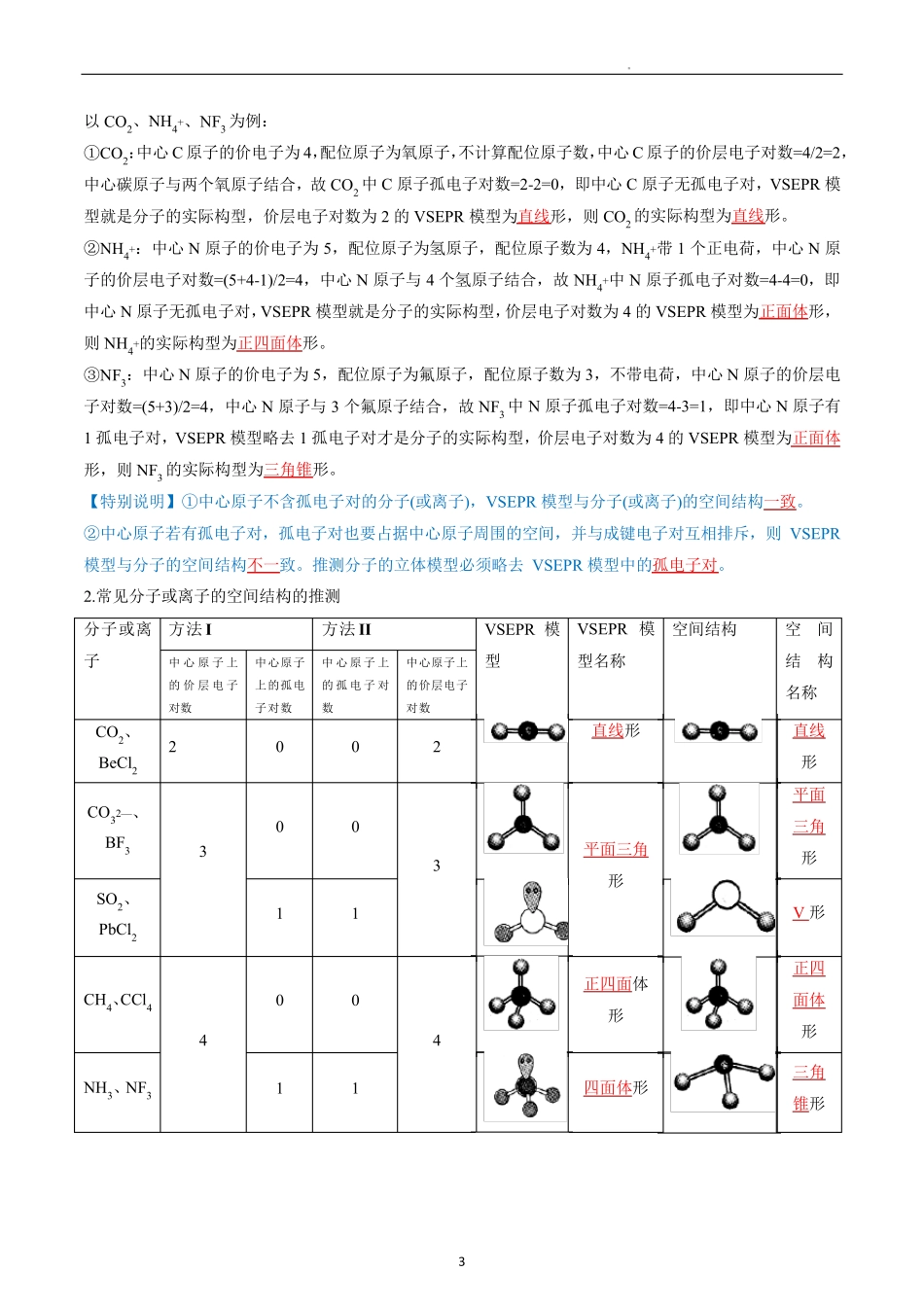
1 价层电子对互斥模型(VSEPR) 1.理解价层电子对互斥理论的含义。 2.能根据价层电子对互斥理论判断简单分子或离子的空间结构。 一、价层电子对互斥模型 1.应用:预测分子的空间结构 2.内容:价层电子对互斥模型认为,分子的空间结构是中心原子周围的“价层电子对” 相互排斥的结果。 (1)当中心原子的价电子全部参与成键时,为使价电子斥力最小,就要求尽可能采取对称结构。 (2)当中心原子的价电子部分参与成键时,未参与成键的孤电子对与成键电子对之间及孤电子对之间、成键电子对之间的斥力不同,从而影响分子的空间结构。 (3)电子对之间的夹角越大,相互之间的斥力越小。 (4)成键电子对之间斥力由大到小的顺序:三键-三键>三键-双键>双键-双键>双键-单键>单键-单键。 (5)含孤电子对的斥力由大到小的顺序:孤电子对-孤电子对>孤电子对-单键>单键-单键。 二、中心原子上的价层电子对数的计算方法 1.方法I:中心原子上的价层电子对数=σ 键电子对数+中心原子上的孤电子对数 (1)σ 键电子对数的确定:由化学式确定 (2)中心原子上的孤电子对数的确定:中心原子上的孤电子对数= 公式中各字母的含义: a 中心原子的价层电子数 主族元素 =最外层电子数 阳离子 =中心原子的价层电子数-︱离子的电荷数︱ 阴离子 =中心原子的价层电子数+︱离子的电荷数︱ x 与中心原子结合的原子数 b 与中心原子结合的原子最多能接受的电子数 H =1 其他原子 =8-该原子的价层电子数 【特别说明】VSEPR 的“价层电子对” 是指分子中的中心原子与结合原子间的σ 键电子对和中心原子上的孤 2 电子对。多重键只计其中的σ 键电子对,不计π 键电子对。 2.方法 II: 说明:(1)中心原子配位的原子总数是指与中心原子直接结合的原子个数,氧族元素原子作配位原子时,不计算配位原子个数。 (2)粒子的电荷数是离子所带电荷数,阳离子用“-” ,阴离子用“+” 。 (3)计算结果为中心原子的价层电子对数,根据中心原子的价层电子对数可以确定价层电子对互斥模型。 (4)孤电子对数=价层电子对数-中心原子配位的原子总数。 三、根据价层电子对互斥模型判断分子或离子的空间结构 1.判断方法 (1)方法I 根据上述方法I 计算出 σ 键电子对数和中心原子上的孤电子对数,在确定了σ 键电子对数和中心原子上的孤电子对数后,可以依据下面的方法确定相应的较稳定的分子或离子的空间结构: σ 键电子对数+孤电子对数=价层电...