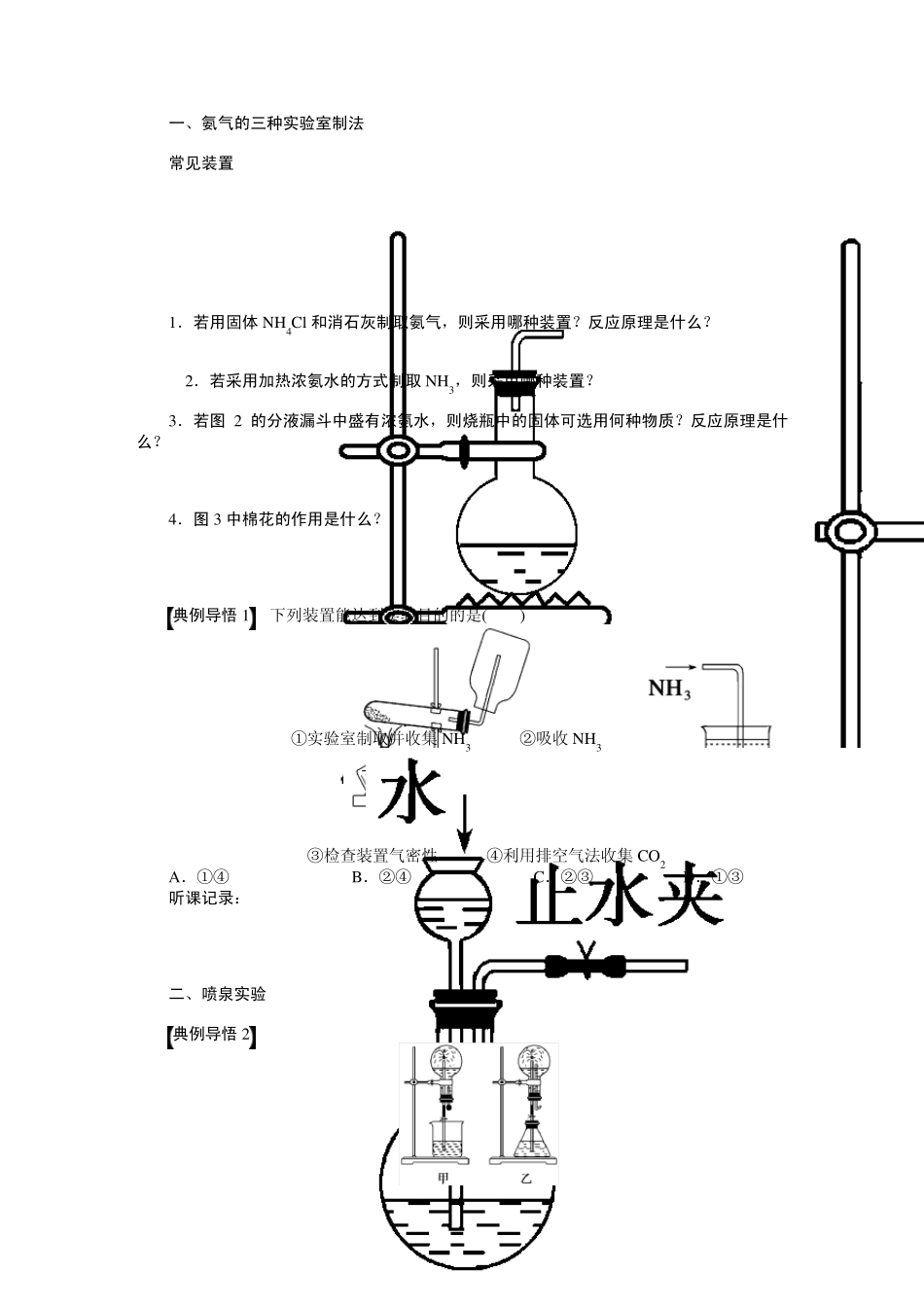
学案2 3 氨和铵盐 [考纲要求] 1.了解氨气、铵盐的性质,掌握氨气的实验室制法和NH+4 的检验。2.初步了解常见化肥的基本性质。 知识点一 氨的分子结构和性质 1.物理性质 氨气是____色________气味的气体,____液化可作制冷剂,常温、常压下,1 体积的水可溶解______体积氨气。 2.分子结构 电子式:____________。 3.氨的化学性质 (1)与水的反应 NH3+H2ONH3·H2ONH+4 +OH-,氨气溶于水得氨水,氨水中含有的粒子有:______________________________。氨水为可溶性一元弱碱,易挥发,不稳定,易分解:NH3·H2O=====△________________。 (2)氨气与酸反应 ①蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近,其现象为____________,将浓盐酸改为__________,也会出现相同的现象。 化学方程式为:___________________________________________________________, ________________________________________________________________________。 ②与CO2 等酸性氧化物反应:NH3 +CO2 +H2O===NH4HCO3 或2NH3 +CO2 +H2O===(NH4)2CO3。 (3)NH3 的还原性— — 氨的催化氧化 化学方程式:____________________________________________________________。 (4)与盐溶液反应 将氨水加入下列溶液 被滴试剂 现象 离子方程式 FeCl3 溶液 生成____色沉淀 AlCl3 溶液 生成____沉淀 Al3++3NH3·H2O===Al(OH)3↓+3NH+4 AgNO3 溶液 问题思考 1.判断下列说法是否正确,不正确的说明理由。 ①氨气溶于水能导电,所以氨气是电解质。 ②实验室用浓氨水与 NaOH 固体制取氨气。 ③氨和酸反应生成铵盐,与挥发性酸相遇时能形成白烟。 ④某晶体与NaOH共热放出一种使湿润的红色石蕊试纸变蓝的气体,该晶体中含有NH+4 。 ⑤氨水中含氮微粒中最多的微粒是NH+4 。 ⑥把 NH3 通入稀 HNO3 中,当溶液的pH 等于 7 时,溶液中 NH3 和 HNO3 等物质的量反应。 2.液氨和氨水有哪些区别?完成下列表格。 液氨 氨水 形成 物质分类 混合物 微粒种类 NH3、NH3·H2O、H+、H2O、NH+4 、OH- 存在条件 常温常压下不能存在 常温常压下可存在 3.喷泉实验成败的关键在哪里? 4.制法 (1)实验室制法:_________________________________________________________。 (2)工业制法:_____________________________________________________________。 问题思考 4.实验室制取 NH3 时...