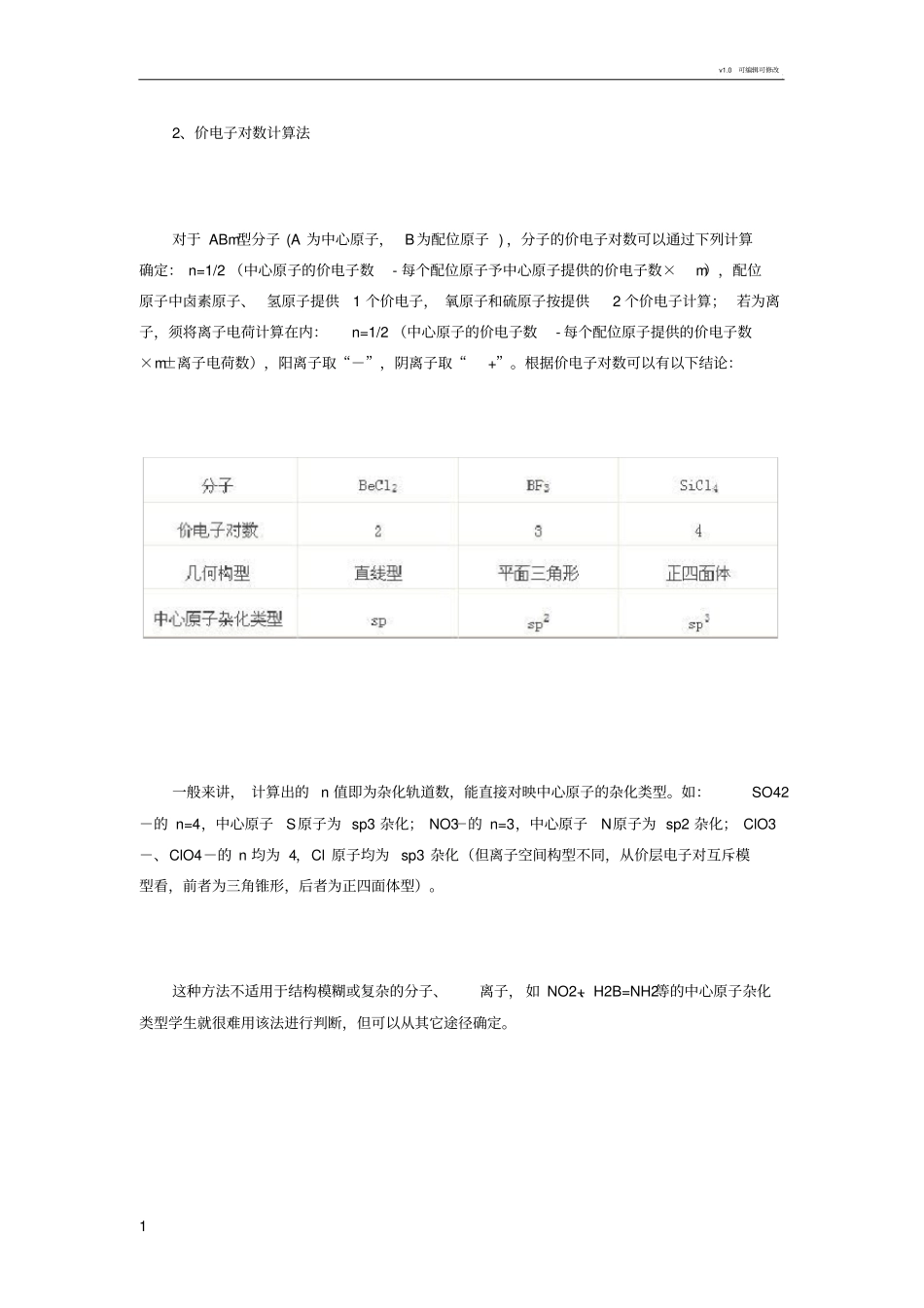
v1.0 可编辑可修改1 2、价电子对数计算法对于 ABm型分子 (A 为中心原子, B为配位原子 ) ,分子的价电子对数可以通过下列计算确定: n=1/2 (中心原子的价电子数- 每个配位原子予中心原子提供的价电子数×m),配位原子中卤素原子、 氢原子提供1 个价电子, 氧原子和硫原子按提供2 个价电子计算; 若为离子,须将离子电荷计算在内:n=1/2 (中心原子的价电子数- 每个配位原子提供的价电子数×m±离子电荷数),阳离子取“-”,阴离子取“+”。根据价电子对数可以有以下结论:一般来讲, 计算出的 n 值即为杂化轨道数,能直接对映中心原子的杂化类型。如:SO42-的 n=4,中心原子S原子为 sp3 杂化; NO3-的 n=3,中心原子N原子为 sp2 杂化; ClO3-、ClO4-的 n 均为 4,Cl 原子均为 sp3 杂化(但离子空间构型不同,从价层电子对互斥模型看,前者为三角锥形,后者为正四面体型)。这种方法不适用于结构模糊或复杂的分子、离子, 如 NO2+、H2B=NH2等的中心原子杂化类型学生就很难用该法进行判断,但可以从其它途径确定。