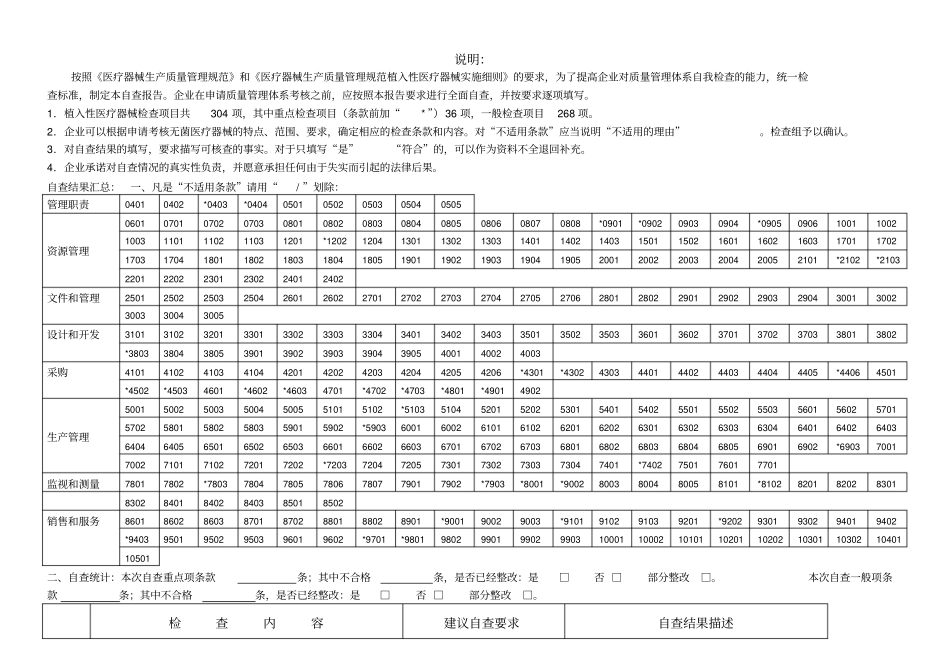
植入性医疗器械生产质量管理规范自查报告自查企业名称(公章) :自查产品名称:自查日期:自查人员(内审员) :管理者代表(签名) :备案号:企业负责人(签名) :广东省食品药品监督管理局编制说明:按照《医疗器械生产质量管理规范》和《医疗器械生产质量管理规范植入性医疗器械实施细则》的要求,为了提高企业对质量管理体系自我检查的能力,统一检查标准,制定本自查报告。企业在申请质量管理体系考核之前,应按照本报告要求进行全面自查,并按要求逐项填写。1.植入性医疗器械检查项目共304 项,其中重点检查项目(条款前加“* ”)36 项,一般检查项目268 项。2.企业可以根据申请考核无菌医疗器械的特点、范围、要求,确定相应的检查条款和内容。对“不适用条款”应当说明“不适用的理由”。检查组予以确认。3.对自查结果的填写,要求描写可核查的事实。对于只填写“是”“符合”的,可以作为资料不全退回补充。4.企业承诺对自查情况的真实性负责,并愿意承担任何由于失实而引起的法律后果。自查结果汇总:一、凡是“不适用条款”请用“/ ”划除:管理职责0401 0402 *0403 *0404 0501 0502 0503 0504 0505 资源管理0601 0701 0702 0703 0801 0802 0803 0804 0805 0806 0807 0808 *0901 *0902 0903 0904 *0905 0906 1001 1002 1003 1101 1102 1103 1201 *1202 1204 1301 1302 1303 1401 1402 1403 1501 1502 1601 1602 1603 1701 1702 1703 1704 1801 1802 1803 1804 1805 1901 1902 1903 1904 1905 2001 2002 2003 2004 2005 2101 *2102 *2103 2201 2202 2301 2302 2401 2402 文件和管理2501 2502 2503 2504 2601 2602 2701 2702 2703 2704 2705 2706 2801 2802 2901 2902 2903 2904 3001 3002 3003 3004 3005 设计和开发3101 3102 3201 3301 3302 3303 3304 3401 3402 3403 3501 3502 3503 3601 3602 3701 3702 3703 3801 3802 *3803 3804 3805 3901 3902 3903 3904 3905 4001 4002 4003 采购4101 4102 4103 4104 4201 4202 4203 4204 4205 4206 *4301 *4302 4303 4401 4402 4403 4404 4405 *4406 4501 *4502 *4503 4601 *4602 *4603 4701 *4702 *4703 *4801 *4901 4902 生产管理5001 5002 5003 5004 5005 5101 5102 *5103 5104 5201 5202 ...