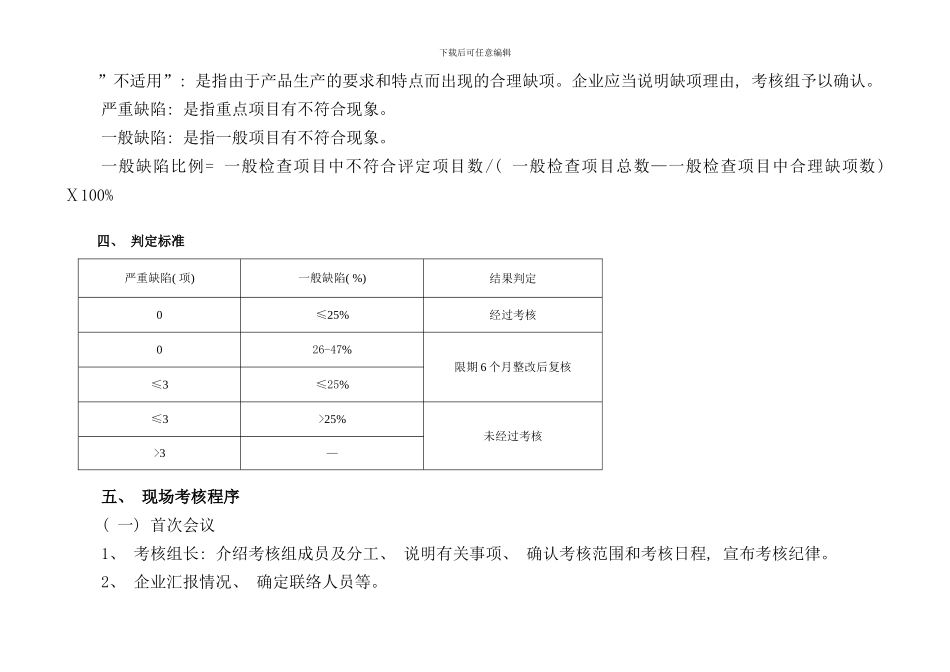
下载后可任意编辑国食药监械〔 〕239 号附件 3体外诊断试剂生产企业质量管理体系考核评定标准( 试行) 国家食品药品监督管理局下载后可任意编辑说 明一、 制定依据依据《体外诊断试剂生产实施细则》( 以下简称《细则》) , 制定本标准。二、 标准结构本标准共分为十一个部分。考核项目共 156 项, 其中重点项目 39 项, 一般项目 117 项。第一部分: 组织机构、 人员与质量管理职责第二部分: 设施、 设备与生产环境控制第三部分: 文件与记录第四部分: 设计控制与验证第五部分: 采购控制第六部分: 生产过程控制第七部分: 检验与质量控制第八部分: 产品销售与客户服务控制第九部分: 不合格品控制、 纠正和预防措施第十部分: 不良事件、 质量事故报告制度第十一部分: 附录 A 体外诊断试剂生产用净化车间环境与控制要求三、 评定方法及标准现场考核时, 考核员应对所列项目及其涵盖的内容根据检查方法进行全面考核, 并对不符合事实做出描述。下载后可任意编辑”不适用”: 是指由于产品生产的要求和特点而出现的合理缺项。企业应当说明缺项理由, 考核组予以确认。严重缺陷: 是指重点项目有不符合现象。一般缺陷: 是指一般项目有不符合现象。一般缺陷比例= 一般检查项目中不符合评定项目数/( 一般检查项目总数—一般检查项目中合理缺项数) Ⅹ100%四、 判定标准严重缺陷( 项) 一般缺陷( %) 结果判定0≤25%经过考核026-47%限期 6 个月整改后复核≤3≤25%≤3>25%未经过考核>3—五、 现场考核程序( 一) 首次会议1、 考核组长: 介绍考核组成员及分工、 说明有关事项、 确认考核范围和考核日程, 宣布考核纪律。2、 企业汇报情况、 确定联络人员等。下载后可任意编辑( 二) 企业联络人员企业联络人员应当是被考核企业负责人或是生产、 技术、 质量管理等部门的负责人, 熟悉生产和质量管理的环节、 要求, 能准确回答考核组提出的有关问题, 不得隐瞒事实。( 三) 考核1、 考核员根据《体外诊断试剂生产企业质量体系考核评定标准》全面查验企业情况 , 对考核项目逐条记录, 发现问题应当仔细核对, 当场向企业指出并加以记录, 企业可对被发现的问题进行解释、 申辩和举证说明。必要时进行现场取证。2、 考核时发现实际情况与企业申报资料不符, 企业负责人应当说明原因或举证, 考核员如实记录。( 四) 综合评定考核员对所负责考核的项目进行情况汇总, 提出评定意见。考核组长组织考核员...