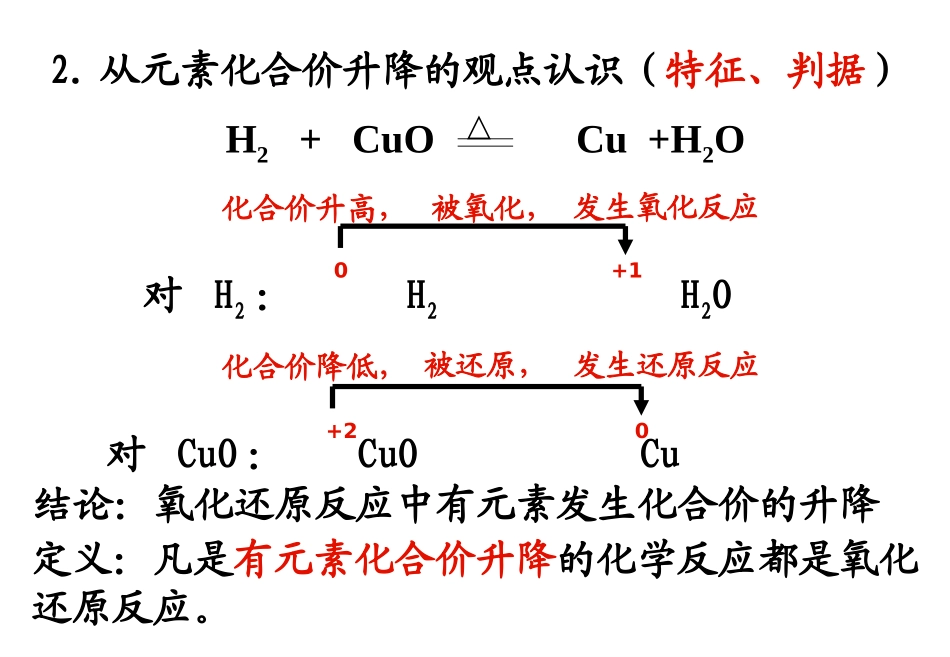
1制作:黑龙江省庆安一中孙秀民第二章化学物质及其变化第三节氧化还原反应一、氧化还原反应(一)氧化还原反应的概念。1.从得氧和失氧的观点认识(初步)H2+CuOCu+H2O△对CuO:CuOCu得到氧,被氧化,发生氧化反应对H2:H2H2O失去氧,被还原,发生还原反应定义:一种物质得到氧被氧化,同时另一种物质失去氧被还原的反应叫做氧化还原反应。2.从元素化合价升降的观点认识(特征、判据)定义:凡是有元素化合价升降的化学反应都是氧化还原反应。对H2:H2H2O0+1对CuO:CuOCu+20结论:氧化还原反应中有元素发生化合价的升降化合价升高,被氧化,发生氧化反应化合价降低,被还原,发生还原反应H2+CuOCu+H2O△氧化还原反应的判断方法是否有元素化合价的升降Fe+CuSO4=FeSO4+CuFeFeSO40+2CuSO4Cu0+2化合价降低化合价升高课堂练习:下列反应中属于氧化还原反应的是()A.CaCO3+2HCl=CaCl2+CO2↑+H2OB.Na2O+H2O=2NaOHC.2KMnO4=K2MnO4+MnO2+O2↑D.MnO2+4HCl=MnCl2+2H2O+Cl2↑E.3Fe+2O2=Fe3O4F.CuSO4·5H2O=CuSO4+5H2OG.2Na+Cl2=2NaCl为了进一步了解氧化还原反应的本质,我们再从电子得失的角度来分析Na和Cl2的反应:2Na+Cl22NaCl点燃2Na2Na+失去失去2e2e--Cl22Cl-得到得到2e2e--2Na+Cl22NaCl△0+10-1失去电子得到电子氯化钠的形成过程9制作:黑龙江省庆安一中孙秀民为了进一步了解氧化还原反应的本质,我们再从电子得失的角度来分析Na和Cl2的反应:2Na+Cl22NaCl点燃2Na2Na+失去失去2e2e--Cl22Cl-得到得到2e2e--2Na+Cl22NaCl△0+10-1失去电子得到电子又如:H2和Cl2的反应H2+Cl22HCl点燃00+1-1化合价升高,被氧化化合价降低,被还原氯化氢分子的形成过程:3.从电子的得失或偏移观点认识(实质)对H2:H2H2O对Cu:CuOCu定义:有电子转移(得失或偏移)的反应都是氧化还原反应。0+1失去电子,被氧化,发生氧化反应得到电子,被还原,发生还原反应+20H2+CuOCu+H2O△小结:氧化还原反应◆从得氧失氧角度分析一种物质得到氧被氧化,同时另一种物质失去氧被还原的化学反应是氧化还原反应。特点:局限于得氧失氧的反应,是氧化还原反应的表观现象。◆从化合价升降角度分析有元素化合价升降的化学反应是氧化还原反应。特点:可作为氧化还原反应的判断依据。◆从电子转移角度分析有电子转移(得失或偏移)的化学反应是氧化还原反应。特点:揭示氧化还原反应的本质。