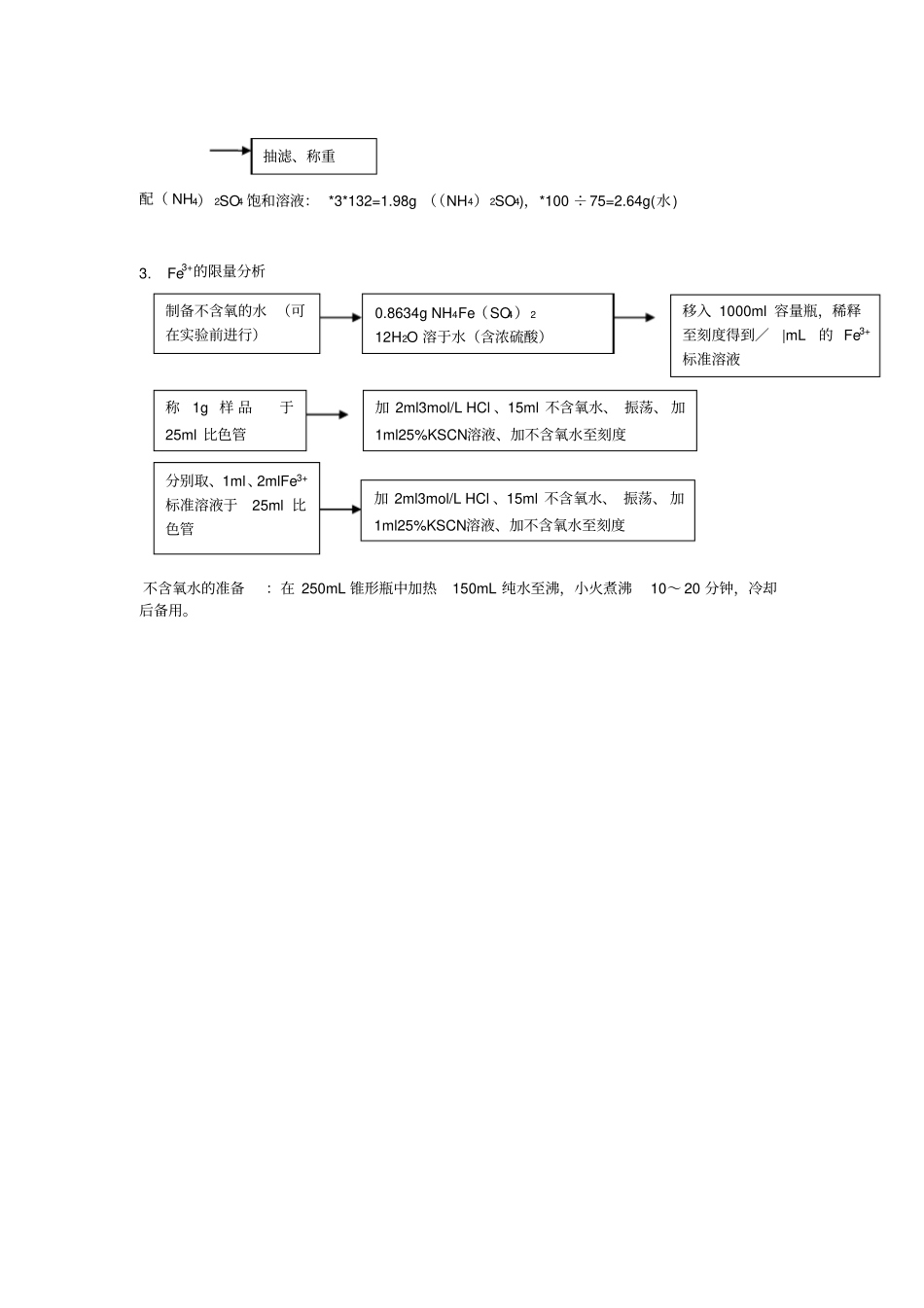
大学化学实验报告本(一)姓名:赵蕾实验室:乙 313 周次:周一实验柜台:61 指导老师:章文伟硫酸亚铁铵的制备一.实验目的1.学会利用溶解度的差异制备硫酸亚铁铵。2.从实验中掌握硫酸亚铁、硫酸亚铁铵复盐的性质3.掌握水浴、减压过滤等基本操作4.学习 pH 试纸、吸管、比色管的使用5.学习用目测比色法检验产品质量。二.原理铁屑溶于稀硫酸生成硫酸铁。硫酸铁与硫酸铵作用生成溶解度较小的硫酸亚铁铵。Fe + H2SO4 = FeSO4 + H2 ↑FeSO4 +(NH4)2SO4+6H2O = FeSO4(NH4)2SO4· 6H2O硫酸铵 / 硫酸亚铁 / 硫酸亚铁铵在不同温度的溶解度数据(单位:g/100g H2O)温度/ ℃0204050607080100硫酸铵----95103七水硫酸亚铁----六水硫酸亚铁铵--3340--52----由于复盐的溶解度比单盐要小,因此溶液经蒸发浓缩、冷却后, 复盐在水溶液中首先结晶,形成 (NH4)2FeSO4·6H2O 晶体。比色原理: Fe3+ + n SCN- = Fe(SCN)n(3-n) (红色 ) 用比色法可估计产品中所含杂质Fe3+的量。 Fe3+由于能与SCN-生成红色的物质[Fe(SCN)]2+,当红色较深时,表明产品中含Fe3+较多;当红色较浅时,表明产品中含Fe3+较少。所以,只要将所制备的硫酸亚铁铵晶体与KSCN溶液在比色管中配制成待测溶液,将它所呈现的红色与含一定Fe3+量所配制成的标准Fe(SCN)]2+溶液的红色进行比较,根据红色深浅程度相仿情况,即可知待测溶液中杂质Fe3+的含量,从而可确定产品的等级。三.仪器及药品洗瓶、 250ml 烧杯、 锥形瓶 (150mL,250mL 各一个) 、移液管 (1mL,2mL 各一根) 10ml量筒、吸滤瓶、比色管(25mL)、比色架、铁粉、2mol/L 盐酸、 3mol/L 硫酸、 25%KSCN四.实验步骤1.硫酸亚铁制备2.硫酸亚铁铵的制备铁屑1gH2SO43mol/L5ml水浴加热, 348K趁热过滤配( NH4) 2SO4饱和溶液加 Fe SO4调 PH 值水浴加热出现结晶膜缓慢冷却配( NH4) 2SO4 饱和溶液: *3*132=1.98g ((NH4) 2SO4),*100 ÷75=2.64g(水)3.Fe3+的限量分析不含氧水的准备:在 250mL 锥形瓶中加热150mL 纯水至沸,小火煮沸10~ 20 分钟,冷却后备用。制备不含氧的水 (可在实验前进行)0.8634g NH4Fe(SO4) 212H2O 溶于水(含浓硫酸)移入 1000ml 容量瓶,稀释至刻度得到/|mL的 Fe3+标准溶液称1g 样 品于25ml 比色管加 2ml3mol/L HCl 、15ml 不含氧水、 振荡、 加1ml25%KSCN溶液、加不含氧水至刻度分别取、1ml、2mlFe3+标准溶液于25ml ...