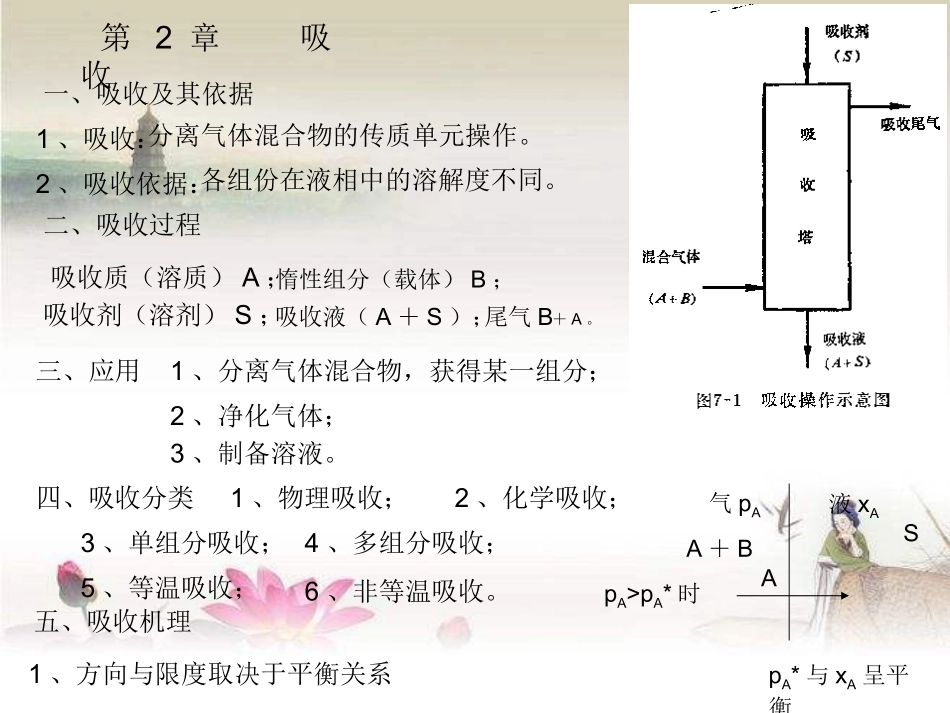
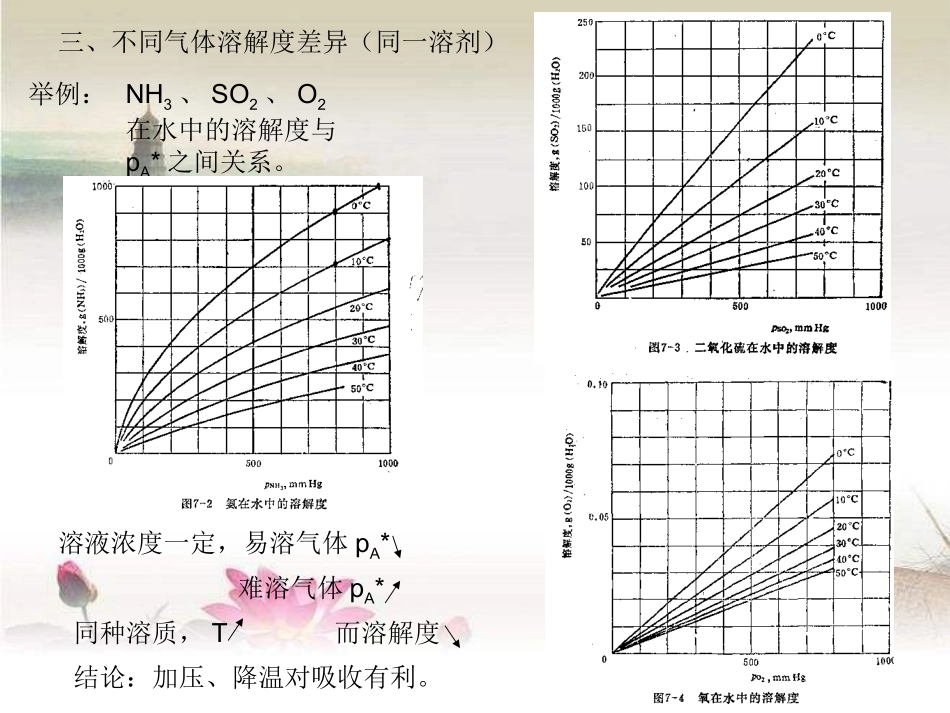
第2章吸收一、吸收及其依据1、吸收:2、吸收依据:分离气体混合物的传质单元操作。各组份在液相中的溶解度不同。二、吸收过程吸收质(溶质)A;惰性组分(载体)B;吸收剂(溶剂)S;吸收液(A+S);尾气B+A。三、应用1、分离气体混合物,获得某一组分;2、净化气体;3、制备溶液。四、吸收分类1、物理吸收;2、化学吸收;3、单组分吸收;4、多组分吸收;5、等温吸收;6、非等温吸收。五、吸收机理1、方向与限度取决于平衡关系气pAA+B液xASApA>pA*时pA*与xA呈平衡2、与蒸馏比较1)同为分离均相物系的气-液传质操作;2)第二个物系蒸馏:产生气相直接得A、B。吸收:外界引入气相不能直接得A、B,需二次分离。3)蒸馏:双向传质吸收:单相传质B、S停滞组份。六、脱吸:当pA>pA*时,进行着吸收逆过程-脱吸。2.1气体吸收的相平衡关系2.1.1气体的溶解度一、溶解度:A、BSACA*T、P一定,气体在液体中的饱和浓度。表明吸收过程可能达到的极限程度。二、温度对溶解度的影响单组份、组分数C=3、(A、B、S)、相数Φ=2。相律:F=C-Φ+2=3-2+2=3CA*=f(t、P总、PA)低压下,t一定CA*=f(PA)三、不同气体溶解度差异(同一溶剂)举例:NH3、SO2、O2在水中的溶解度与pA*之间关系。溶液浓度一定,易溶气体pA*难溶气体pA*同种溶质,T而溶解度结论:加压、降温对吸收有利。2.1.2亨利定律一、亨利(Henry)定律P总不高,T一定,p*=Ex(2-1)说明:1、p*、x、E(亨利系数,压强单位)xp*实际浓度平衡分压2、适用于t一定,理想溶液。E为该t下纯溶质p°;3、用于难溶、较难溶气体(或易溶稀溶液);4、难溶气体,E为常数;5、E由实验测定,查手册(P78);6、E=f(T),TE(即TCA*),因此,难溶E,而易溶E二、Henry定律的其它形式1、2)-(2Hcp*说明:①C为体积摩尔浓度[kmol/m3];②H为溶解度系数[kmol/kN.m];③H~E关系:推导:1m3:溶质[kmol/m3]溶剂kmolMMc-ssA则x溶质+溶剂溶质MMc-ccSA)M-c(MMcASS)M-c(McMEp*ASS)M-c(MMEH1ASS4)-(2EMHS④H=f(T)TH易溶H难溶H2、y*=mx(2-5)说明:①m相平衡常数,无因次;②m~E:yPp*yPp*:xEp*代入xEy*PxPEy*总与y*=mx比较:6)-(2PEm总③m实验值m=f(T)TP总m(x)不利。3、B、S摩尔量不变(基准)]kmolSkmolA[x-1xXX1Xx]kmolBkmolA[y-1yYY1Yy代入y*=mx:X1Xm*Y1*Ym)X-(11XmY*10)-(2xmY*低浓度:XYp*=Ex(2-1)2)-(2Hcp*y*=mx(2-5)10)-(2xmY*2.1.3吸收剂的选择1、溶解度;2、选择性;3、挥发度;4、粘性;5、其它。2.1.4相平衡关系在吸收过程中的应用1、判断传质进行的方向**iiyyiixx或若传质方向为:气相液相吸收反之,传质方向为:液相气相脱收总之,溶质传递的方向是趋于平衡的方向。2、确定传质的推动力iixx**iiyy或推动力为3、指明传质过程进行的极限2.2吸收机理与吸收速率吸收glA扩散分子扩散涡流扩散:流体分子无规则的热运动而传递物质。(静止或滞流):靠流体质点的湍动和旋涡而传递物质的。(湍流)2.2.1分子扩散与菲克(Fick)定律一、分子扩散1、概念在单相内部有浓度差的条件下,分子的无规则热运动而造成的物质传递现象。简称扩散。2、举例AB传递方向:A、B各自沿着浓度降低的方向传递。推动力:浓度差。二、菲克(Fick)定律11)-(2dZdC-DJAABAJA-物质A在Z方向上的扩散通量,kmol/(m2.s);dZdCA-A的浓度梯度,kmol/m4;DAB-物质A在介质B中的分子扩散系数。负号-表明扩散是沿着物质A浓度降低的方向进行的。A、B在Z方向互为相反值:12)-(2dZdC-dZdCBA而且,BA-JJ根据Fick定律:dZdC-DJAABAdZdC-DJBBAB13a)-(2-DDBAAB作业:P150-1、22.2.2气相中的稳定分子扩散一、等分子反向扩散pA1>pA2,pB2>pB1两容器T、P相同。精馏传递速率NA:在任意固定的空间位置上,单位时间通过单位面积的物质量A[kmol/m2.s]。NA不涉及传递形式。推导NA计算式:1、现象2、传递速率NA(传质速率)NA=JAdZdC-DAdZdpRTD-A稳定过程,NA为常数。因而dZdpA也是常数,故pA~Z为直线关系。(2-15)dZdpRTD-dZNAA0pA1ZpA216)-...