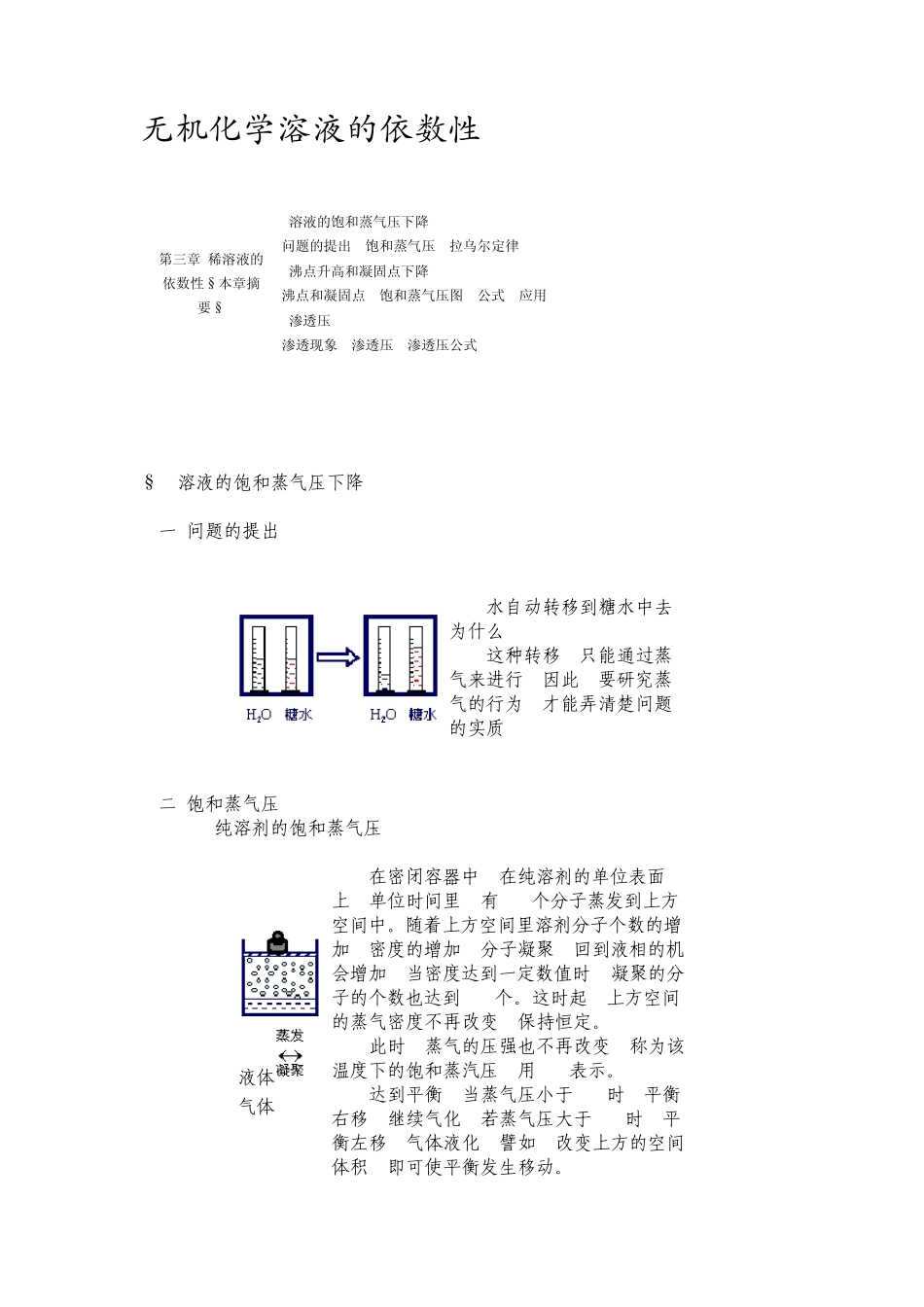
无机化学溶液的依数性 第三章 稀溶液的依数性§本章摘要§ 1. 溶液的饱和蒸气压下降 问题的提出 饱和蒸气压 拉乌尔定律 2. 沸点升高和凝固点下降 沸点和凝固点 饱和蒸气压图 公式 应用 3. 渗透压 渗透现象 渗透压 渗透压公式 §1 溶液的饱和蒸气压下降 一 问题的提出 水自动转移到糖水中去, 为什么? 这种转移, 只能通过蒸气来进行. 因此, 要研究蒸气的行为, 才能弄清楚问题的实质. 二 饱和蒸气压 1. 纯溶剂的饱和蒸气压 (P0) 液体气体 在密闭容器中, 在纯溶剂的单位表面上, 单位时间里, 有 N0 个分子蒸发到上方空间中。随着上方空间里溶剂分子个数的增加, 密度的增加, 分子凝聚, 回到液相的机会增加. 当密度达到一定数值时, 凝聚的分子的个数也达到 N0 个。这时起, 上方空间的蒸气密度不再改变, 保持恒定。 此时, 蒸气的压强也不再改变, 称为该温度下的饱和蒸汽压, 用 P0 表示。 达到平衡. 当蒸气压小于 P0 时, 平衡右移, 继续气化; 若蒸气压大于 P0 时, 平衡左移, 气体液化. 譬如, 改变上方的空间体积, 即可使平衡发生移动。 2.溶液的饱和蒸气压 (P) 当溶液中溶有难挥发的溶质时, 则有部分溶液表面被这种溶质分子所占据, 如图示: 于是, 在溶液中, 单位表面在单位时间内蒸发的溶剂分子的数目 N 要小于 N0 。 凝聚分子的个数当然与蒸气密度有关. 当凝聚的分子数目达到 N, 实现平衡时, 蒸气压已不会改变. 这时, 平衡状态下的饱和蒸气压为:P
P, 即 H2O 并未平衡, 继续蒸发, 以致于蒸气压大于 P. H2O 分子开始凝聚到糖水中, 使得蒸气压不能达到 P0. 于是, H2O 分子从 H2O 中蒸出而凝聚入糖水. 出现了本节开始提出的实验现象. 变化的根本原因是溶液的饱和蒸气压下降。 三 拉乌尔定律 (Laoult, 法国) 1. 溶液的浓度 每溶液中含溶质的摩尔数, 为摩尔浓度. 这种浓度使用方便, 唯一不足, 是和温度有关。若用每 Kg 溶剂中含溶质的摩尔数, 则称为质量摩尔浓度, 经常用 m 表示。 摩尔分数: 对于稀溶液, 由于 n质<< n剂, 故有: 对于稀的水溶液, 则有: 对于 1000g 溶剂水, 则有: 这时, n质 的意义是 1000g 水中含的溶质的摩尔...