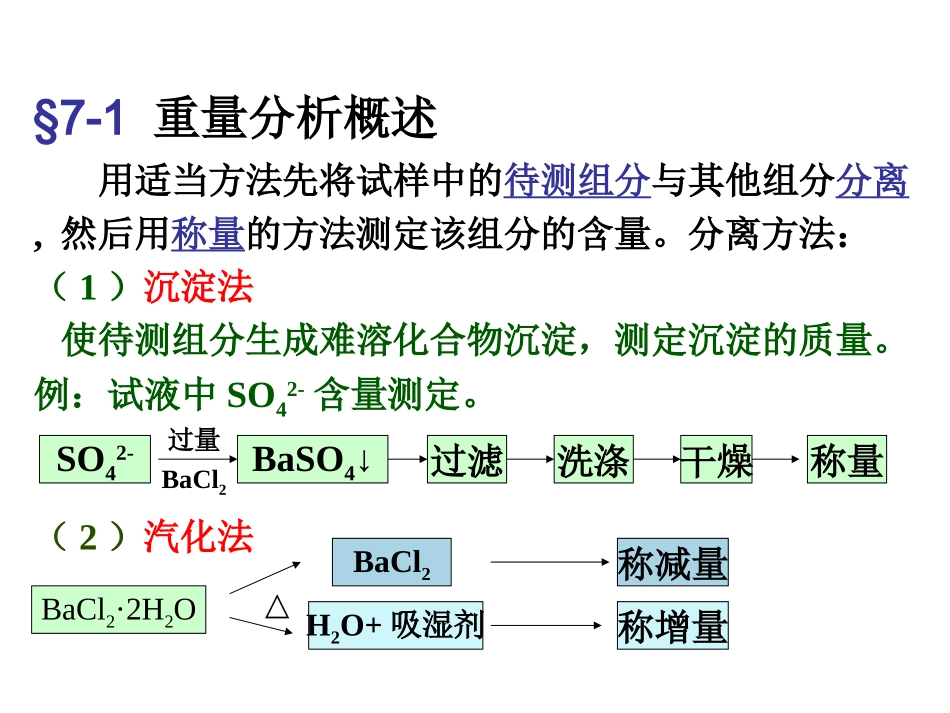
第七章重量分析法和沉淀滴定法Chapter7GravimetryandPrecipitationtitrametry§7-1重量分析概述用适当方法先将试样中的待测组分与其他组分分离,然后用称量的方法测定该组分的含量。分离方法:(1)沉淀法使待测组分生成难溶化合物沉淀,测定沉淀的质量。例:试液中SO42-含量测定。SO42-过量BaCl2BaSO4↓过滤洗涤干燥称量(2)汽化法BaCl2·2H2OBaCl2称减量H2O+吸湿剂△称增量讨论:优缺点(1)全部数据都是由分析天平称量得来,避免误差;(2)高含量组分的测定比较准确,相对误差<0.1%;高含量硅、磷、钨、稀土元素等试样的精确分析(3)不足之处是操作较繁,费时,不适于生产中的控制分析,对低含量组分的测定误差较大;(4)沉淀法应用较多。沉淀法关键:沉淀剂的选择与用量,沉淀反应条件,如何减少沉淀中杂质。§7-2重量分析对沉淀的要求沉淀形式Mg2+MgNH4PO4·6H2O↓过滤灼烧称量形式Mg2P2O7洗涤SO42-BaSO4↓过滤洗涤灼烧BaSO4不一致一致Q:对沉淀形式和称量形式有哪些要求?一对沉淀形式的要求1.沉淀要完全沉淀的溶解度要小。例:测Ca2+,CaSO4:Ksp=2.45×10-5CaC2O4:Ksp=1.78×10-9更好2.沉淀要纯净尽量避免混进杂质,易于过滤和洗涤。颗粒较粗的晶形沉淀:MgNH4PO4·6H2O,过滤快、吸附杂质少、易洗涤。颗粒细小的晶形沉淀:CaC2O4、BaSO4等,非晶形沉淀:Al(OH)3,效果不好,用有机沉淀剂。3.易转化为称量形式二对称量形式的要求1.组成必须与化学式完全符合例:磷钼酸铵(溶解度很小的晶形沉淀),组成不定;常采取磷钼酸喹啉作为测定PO43-的称量形式。2.称量形式要稳定不易吸收空气中的H2O和CO2,不易分解等。例:CaC2O4·H2O灼烧后得到CaO不宜作为称量形式3.称量形式的摩尔质量尽可能地大减少称量误差。三沉淀剂的选择根据上述对沉淀形式的要求来考虑沉淀剂的选择。1.沉淀剂应具有较好的选择性例:丁二酮肟和H2S都可沉淀Ni2+,但常选用前者。沉淀锆离子选苦杏仁酸(特效),钛、铁、钒、铝等十多种离子不发生干扰。2.选用易挥发或易灼烧除去的沉淀剂沉淀中带有的沉淀剂可以借烘干或灼烧而除去。铵盐和有机沉淀剂(发展较快)都能满足这项要求。§7-3沉淀完全的程度与影响沉淀溶解度的因素一沉淀平衡,溶度积MA(固)=M++A-(溶液)活度积Kap=aM+·aA-aM+=γM+·cM+;aA-=γA-·cA-带入上式Kap=cM+·cA-γM+·γA-纯水中MA的溶解度很小:S0=[M+]=[A-]cM+·cA-=S02=Ksp(溶度积)溶度积Ksp只在一定条件下才是一个常数。二影响沉淀溶解度的因素1.共同离子效应(common-ioneffect)2.要求沉淀溶解损失不能超过一般称量的精确度(0.2mg)例:BaCl2+SO42-→BaSO4↓(Ksp=8.7×10-11)(1)当加入BaCl2的量与SO42-的量符合化学计量关系时,在200mL溶液中溶解的BaSO4质量为:mg4.0g0004.01000200233107.811(2)加入过量的BaCl2([Ba2+]=0.01mol·L-1)时:求[SO42-]mg00040g100410002002330101078711....-沉淀剂决不能加得太多,否则可能发生其他影响。Ksp[Ba2+]2.盐效应(salteffect)在难溶电解质的饱和溶液中,加入其他强电解质,会使难溶电解质的溶解度比同温度时在纯水中的溶解度增大,这种现象称为盐效应。例:KNO3存在下,AgCl、BaSO4的溶解度比在纯水中大KNO3浓度:0→0.01mol·L-1,AgCl的溶解度:1.28×10-5→1.43×10-5mol·L-1。原因:强电解质的浓度↑,活度系数↓Kap为常数,[M+][A-]↑溶解度↑3.酸效应溶液的酸度对沉淀溶解度的影响,称为酸效应。溶液中[H+]大小对弱酸、多元酸或难溶酸离解平衡有影响,对强酸盐无影响。H2C2O4===HC2O4-===C2O42--H++H+Ka1-H++H+Ka2[C2O42-]总=[C2O42-]+[HC2O4-]+[H2C2O4][Ca2+][C2O42-]总=Ksp(CaC2O4)·C2O4(H)=K’sp(CaC2O4)草酸钙溶解度↑则S↑沉淀的溶解度随溶液酸度增加而增加。例:草酸(H)OCsp'sp2422OCaC4242]O[C][CaKKS总4.配位效应若溶液中存在配位剂,能与生成沉淀的离子形成配合物,使沉淀溶解度增大,甚至不产生沉淀的现象。例:Ag++Cl-→AgCl↓+Cl-→AgCl2-+AgCl32-NH3+Ag+→[Ag(NH3)2]+AgCl在0.01mol·L-1氨水中溶解度比在纯水中大40倍。AgCl在0.01mol·L-1HCl溶液中的溶解...