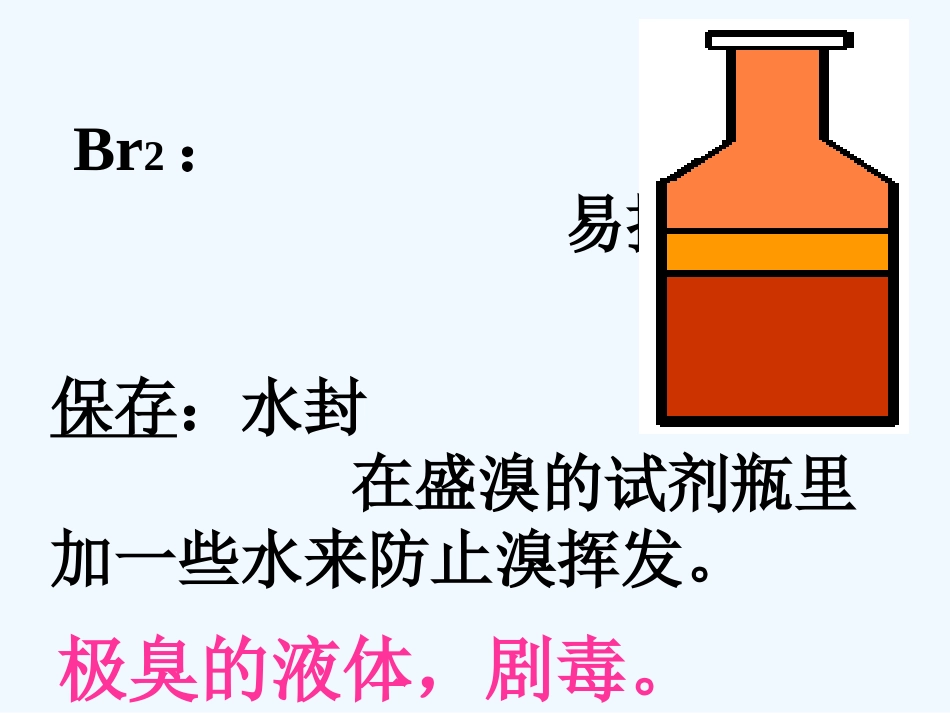
Br2:易挥发保存:水封在盛溴的试剂瓶里加一些水来防止溴挥发。极臭的液体,剧毒。◆下列能使淀粉变蓝的物质是()A.KIB.KCIC.I2D.Br2◆下列物质中,不能使湿润的淀粉碘化钾试纸变蓝的是()A.碘水B.溴水C.氯化钾溶液D.氯气CC振荡振荡碘水碘水CClCCl44水汽油、苯四氯化碳溴碘橙黄橙红色棕黄色紫红色溴和碘在不同溶剂中所生成溶液的颜色碘酒就是碘的酒精溶液,呈棕褐色。1.检验分液漏斗活塞和上口的玻璃塞是否漏液用用CClCCl44萃取碘水中的碘并分萃取碘水中的碘并分液液如何试漏?实验实验实验过程实验过程主要仪器主要仪器分液漏斗、铁架台、烧杯※※萃取与分液实验操作萃取与分液实验操作3.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正。2.把10毫升碘水和4毫升CCl4加入分液漏斗中,并盖好玻璃塞。萃取和分液4.把分液漏斗放在铁架台的铁圈中,静置,分层。5.将漏斗上口的玻璃塞打开(或使塞上的凹槽或小孔对准漏斗口上的小孔)。萃取和分液6.旋开活塞,用烧怀接收溶液7.将上层水溶液从分液漏斗上口倒出萃取和分液实验步骤小结①查漏②加液、加萃取剂③振荡④静止、分层⑤放液(上、下各自出)Cl2+2NaBr→2NaCl+Br2Cl2+2KI→2KCl+I2Br2+2KI→2KBr+I2F-Cl-Br-I-氧化性逐渐减弱还原性逐渐增强1、氧化性还原性递变规律F2Br2I2Cl2单质颜色密度状态熔沸点浅黄绿色黄绿色深红棕色紫黑色气体气体液体固体增大升高2、卤素单质物理性质的变化规律((11)卤素与金属的反)卤素与金属的反应应卤素单质与大多数金属在一定条件下可以发生反应。Fe+I2→FeI22Fe+3Br2→2FeBr32Fe+3Cl2→2FeCl3单质碘与变价金属反应生成的是低价金属碘化物。(2)卤素与氢气的反应单质反应条件化学方程式生成氢化物稳定性F2Cl2Br2I2光照或点燃(光照爆炸)稳定冷暗处爆炸5000C高温(缓慢化合)高温持续加热(缓慢反应,且反应进行得不完全)很稳定较不稳定很不稳定H2+I22HI△H2+F22HFH2+Cl22HCl光照H2+Br22HBr5000C结论:与氢气反应的剧烈程度逐渐减弱,反应越来越难进行,生成的氢化物的稳定性也逐渐降低暗光照5000CH2+X2→2HX(X=F、Cl、Br、I)不断加热(3)卤化氢(HX)的性质①卤化氢均为无色,刺激性气体②卤化氢均极易溶于水,生成氢卤酸,故易在空气中形成白雾(酸雾)④氢卤酸酸性递变规律:HFI2B.原子半径:I>BrC.还原性:HI>HBrD.颜色:氟气>氯气D都可练习:ADAC含溴化合物有广泛的用途含溴化合物有广泛的用途AgBrAgBr--------黑白照片底片、相纸的感光材料黑白照片底片、相纸的感光材料溴和汞的化合物溴和汞的化合物--------红药水红药水三溴片三溴片----------镇静剂镇静剂二溴乙烷二溴乙烷--------汽油抗震剂汽油抗震剂溴青霉素酸--青霉素溴青霉素酸--青霉素甲基溴--杀虫剂甲基溴--杀虫剂溴钨化合物--溴钨灯溴钨化合物--溴钨灯还有的:二溴乙烷还有的:二溴乙烷--------汽油抗震剂汽油抗震剂溴青霉素酸--青霉素溴青霉素酸--青霉素甲基溴--杀虫剂甲基溴--杀虫剂等等等等・・・・・・・・・・・・AgBr----AgBr----黑白照片底片、相纸的感光材料黑白照片底片、相纸的感光材料溴和汞的化合物溴和汞的化合物--------红药水红药水三溴片三溴片----------镇静剂镇静剂(适应症:镇痛药,(适应症:镇痛药,神经衰弱,歇斯底里症。神经衰弱,歇斯底里症。)溴钨化合物溴钨化合物--溴钨灯--溴钨灯Br—浓度海水0.0672g/L卤水(晒盐之后)2.5~3g/LBr...