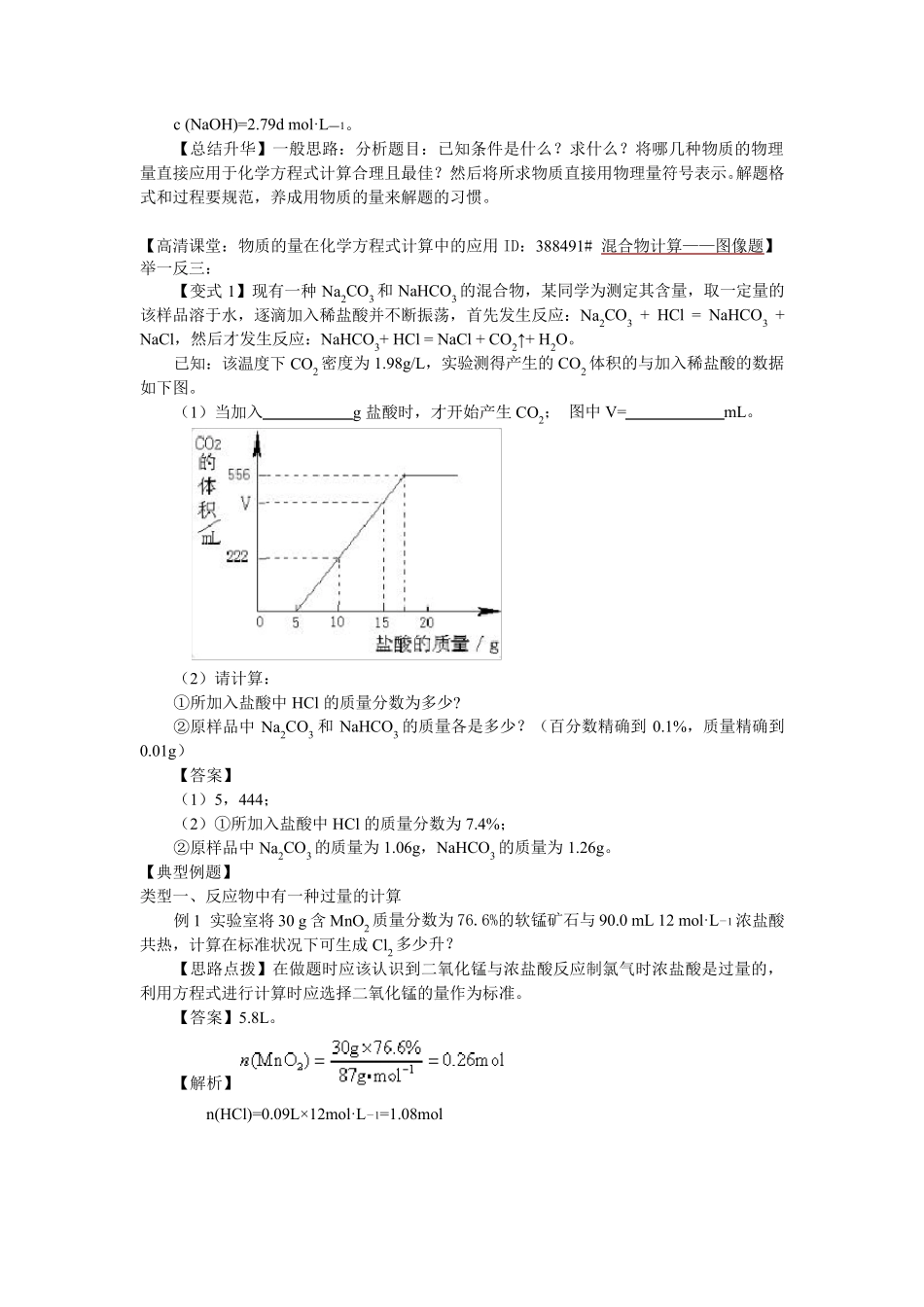
物质的量在化学方程式计算中的应用练习题及答案 【典型例题】 类型一、反应物中有一种过量的计算: 例1 实验室将 30 g 含 MnO2 质量分数为 76.6%的软锰矿石与 90.0 mL 12 mol·L-1 浓盐酸共热,计算在标准状况下可生成 Cl2 多少升? 【思路点拨】在做题时应该认识到二氧化锰与浓盐酸反应制氯气时浓盐酸是过量的,利用方程式进行计算时应选择二氧化锰的量作为标准。 【答案】5.8L。 【解析】 n(HCl)=0.09L× 12mol·L-1=1.08mol 举一反三: 【高清课堂:物质的量在化学方程式计算中的应用ID:388491#例题1】 【变式1】将 6.5g Zn 放入足量盐酸中,Zn 完全反应。计算: (1)6.5 g Zn 的物质的量; (2)参加反应的HCl 的物质的量; (3)生成 H2 的体积(标准状况)。 【答案】 (1)6.5 g Zn 的物质的量为 0.1mol; (2)参加反应的HCl 的物质的量0.2mol; (3)生成 H2 的体积(标准状况)为 2.24L。 【解析】 (1)6.5 g Zn 的物质的量为; 由题意知 HCl 过量 类型二、两量差列比例解计算题 例2 将 5.29gNaCl 和 NaBr 的混合物溶于水后通入足量的Cl2 使之充分反应,再将反应后溶液加热蒸干、灼烧,得到残渣质量 4.40g。计算原混合物中 NaCl、NaBr 的质量。 【思路点拨】该题只给出了处理前后混合物的质量,且质量变化了,找出质量变化的原因,利用差量法解题。 【答案】原混合物中 NaCl 的质量为 3. 23g,原混合物中 NaBr 的质量为 2.06g。 【解析】由于 NaCl 不参与反应,故引起固体物质质量减少的原因是 NaBr 转化为 NaCl 设原混合物中 NaBr 的质量为 m(NaBr) 解得:m(NaBr)=2.06 g。 原混合物中 NaCl 的质量为:5.29-2.06g=3. 23g。 【总结升华】当某一反应有气体参加或有气体生成,且同一条件下反应方程式前后气体物质的化学计量数不相等时,反应前后的总体积存在差量;当反应物或生成物部分为固体、部分为气体时,反应体系中固体物质总质量在反应前后存在差量。即可用两量差列比例求解。 例 3 把一块表面已部分被氧化的钠 0.77 g 放入 10 g 水中,得到标准状况下氢气 224 mL。求 (1)若将金属钠表面的氧化物均视为氧化钠,试求该氧化钠的质量。 (2)所得溶液中溶质的质量分数和该溶液的物质的量浓度(溶液的密度为 d g·cm-3)。 【思路点拨】做问题(1)时弄清楚氢气是由钠和水反应生成的,根据氢气的量求金属钠的质量,进而求氧...