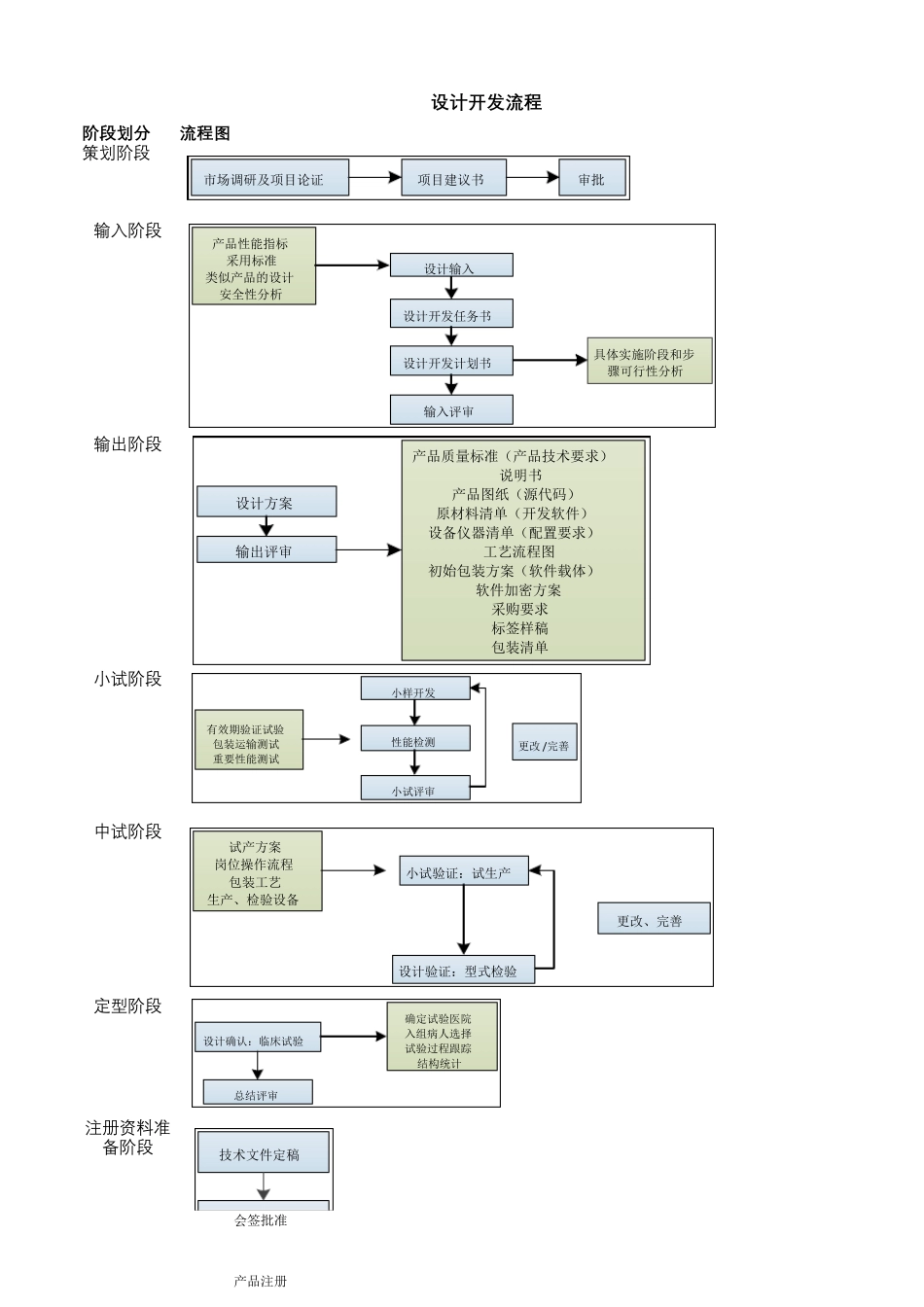
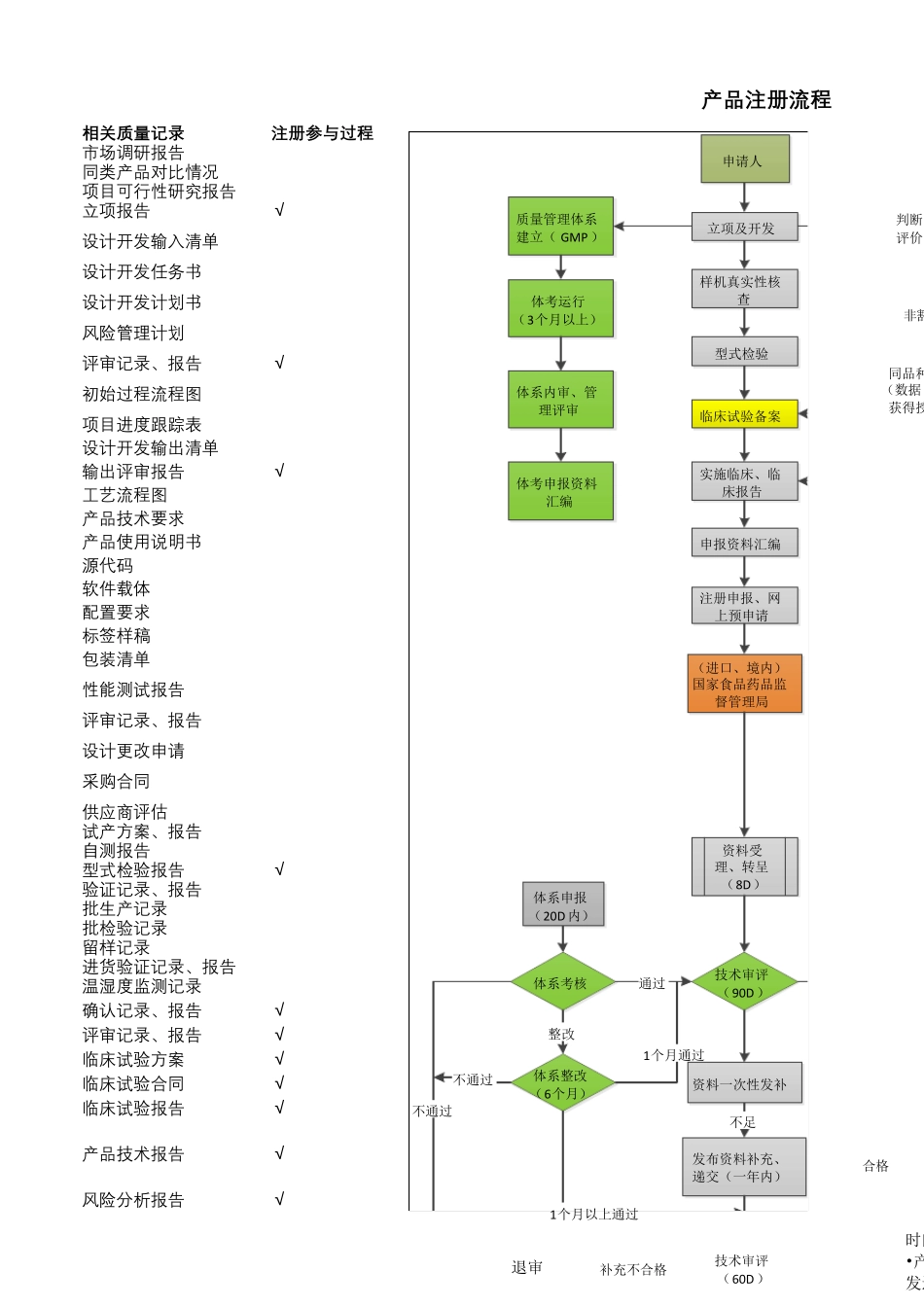
阶 段 划 分流程图输 出 阶 段注 册 资 料 准备 阶 段设计开发流程小 试 阶 段中试 阶 段定型阶 段策划阶 段输 入阶 段市场调研及项目论证项目建议书审批产品性能指标采用标准类似产品的设计安全性分析设计输入设计开发任务书设计开发计划书输入评审具体实施阶段和步骤可行性分析设计方案输出评审产品质量标准(产品技术要求)说明书产品图纸(源代码)原材料清单(开发软件)设备仪器清单(配置要求)工艺流程图初始包装方案(软件载体)软件加密方案采购要求标签样稿包装清单小样开发性能检测小试评审有效期验证试验包装运输测试重要性能测试更改/ 完善小试验证:试生产设计验证:型式检验试产方案岗位操作流程包装工艺生产、检验设备更改、完善设计确认:临床试验总结评审确定试验医院入组病人选择试验过程跟踪结构统计技术文件定稿会签批准产品注册注 : 其 中红色字体文件是注 册需要递交的文件备阶段技术文件定稿会签批准产品注册相 关 质 量 记 录注 册 参 与 过 程市 场 调 研 报 告同 类 产 品 对 比 情 况项 目 可 行 性 研 究 报 告立 项 报 告√设计开发输入清单设计开发任务书设计开发计划书风险管理计划评审记录、报 告√初始过程流程图项 目 进度跟踪表设计开发输出清单输出评审报 告√工艺流程图产 品 技术要求产 品 使用说明书源代码软件载体配置要求标签样稿包装清单性 能测试报 告评审记录、报 告设计更改申请采购合同供应商评估试产 方案、报 告自测报 告型式检验报 告√验证记录、报 告批生产 记录批检验记录留样记录进货验证记录、报 告温湿度监测记录确认记录、报 告√评审记录、报 告√临床试验方案√临床试验合同√临床试验报 告√产 品 技术报 告√风险分析报 告√ 产 品 注 册 流 程申请人立项及开发样机真实性核查型式检验临床试验备案实施临床、临床报告申报资料汇编注册申报、网上预申请(进口、境内)国家食品药品监督管理局质量管理体系建立(GMP)体考运行(3个月以上)体系内审、管理评审体考申报资料汇编判断评价非豁同品种(数据获得授资料受理、转呈(8D)技术审评(90D )体系申报(20D 内)体系考核体系整改(6个月)整改资料一次性发补发布资料补充、递交(一年内)不足技术审评(60D )合格通过1个月通过1个月以上通过退审 补充不合格不通过不通过时间•产发过产 品 说 明 书√临床试验报告√发布资...