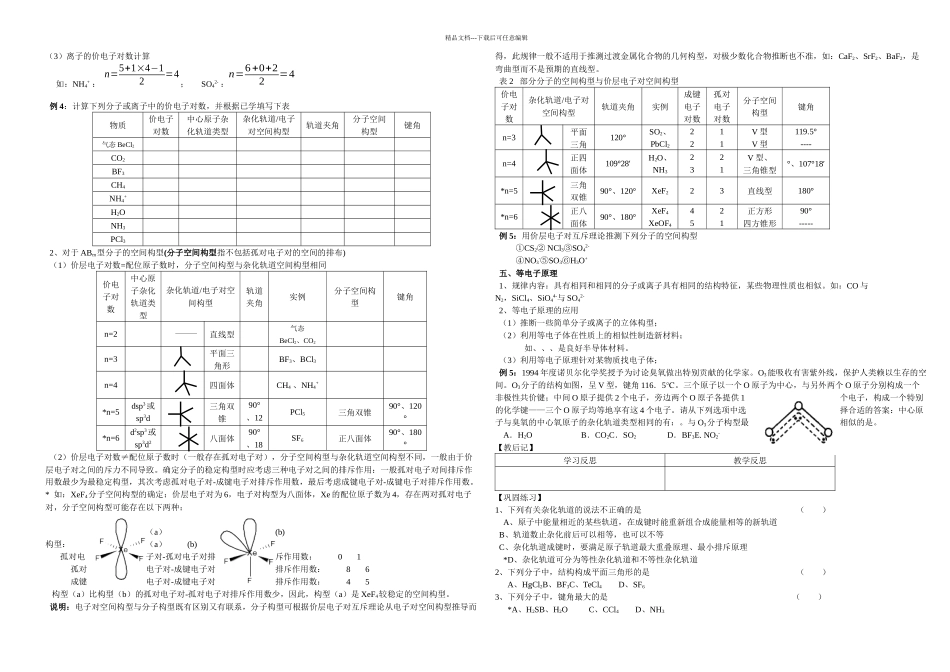
精品文档---下载后可任意编辑【学习目标】1、理解杂化轨道理论的主要内容,掌握三种主要的杂化轨道类型;2、学会用杂化轨道原理解释常见分子的成键情况与空间构型;3、掌握价层电子对互斥理论,知道确定分子空间构型的简易方法;4、了解等电子原理及其应用。【学习重点】杂化轨道理论、价层电子对互斥理论、分子空间构型的简易方法、等电子原理【学习难点】杂化轨道理论、价层电子对互斥理论【学习过程】〖你知道吗〗1、O 原子与 H 原子结合形成的分子为什么是 H2O,而不是 H3O 或 H4O?2、C 原子与 H 原子结合形成的分子为什么是 CH4,而不是 CH2?CH4分子为什么具有正四面体结构?3、为什么 H2O 分子是“V”°,而不是“直线型”或键角是“90°”?一、杂化轨道理论()1、CH4—— sp3杂化轨道排布式:电子云示意图:(1)能量相近的原子轨道才能参加杂化;(2)杂化后的轨道一头大,一头小,电子云密度大的一端与成键原子的原子轨道沿键轴方向重叠,形成 σ 键;由于杂化后原子轨道重叠更大,形成的共价键比原有原子轨道形成的共价键稳定,所以 C 原子与 H 原子结合成稳定的CH4,而不是 CH2。(3)杂化轨道能量相同,成分相同,如:每个 sp3杂化轨道占有个 s 轨道、个 p 轨道;(4)杂化轨道总数等参加杂化的原子轨道数目之和,如个 s 轨道和个 p 轨道杂化成个 sp3杂化轨道(5)正四面体结构的分子或离子的中心原子,一般实行 sp3杂化轨道形式形成化学键,如 CCl4、NH4+等,原子晶体金刚石、晶体硅、SiO2等中 C 和 Si 也实行 sp3杂化形式,轨道间夹角为。2、BF3—— sp2杂化型用轨道排布式表示 B 原子实行 sp2杂化轨道成键的形成过程:电子云示意图:(1)每个 sp2杂化轨道占有个 s 轨道、个 p 轨道;(2)sp2杂化轨道呈型,轨道间夹角为;(3)中心原子通过 sp2杂化轨道成键的分子有、等。〖思考、讨论〗根据现代价键理论即“电子配对理论”,Be 原子外围电子排布式为 2s2,电子已配对不能形成共价键,但气态 BeCl2分子却能稳定存在,为什么?3、气态 BeCl2—— sp 杂化型用轨道排布式表示 Be 原子实行 sp 杂化轨道成键的形成过程:电子云示意图:(1)每个 sp 杂化轨道占有个 s 轨道、个 p 轨道;(2)sp 杂化轨道呈型,轨道间夹角为;(3)中心原子通过 sp 杂化轨道成键的分子有、等。〖思考〗为何不能形成气态 BeCl4分子?【例题选讲】例 1:根据乙烯、乙炔分子的结...