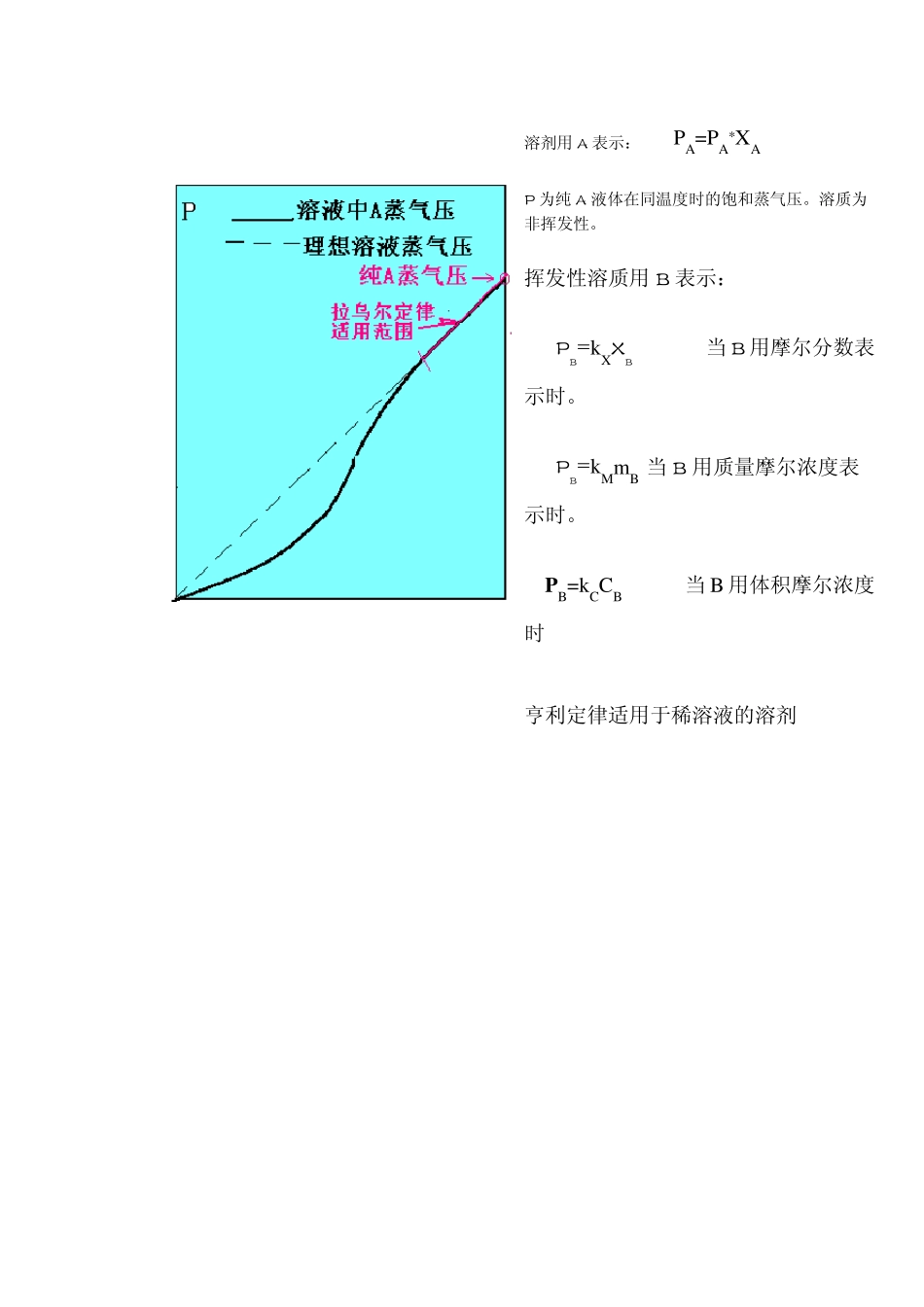
拉乌尔定律和亨利定律--溶液的蒸气压 我们知道,液体可以蒸发成气体,气体也可以凝结为液体。在一定的温度下,二者可以达成平衡,即液体的蒸发速度等于蒸气的凝结速度。达到这种平衡时,蒸气有一定的压力,这个压力就叫做此液体的饱和蒸气压(简称蒸气压)。蒸气压与温度有关,温度越高,分子具有的动能越大,蒸发速度越快,因而蒸气压越大。 溶液的蒸气压除与温度有关外,还与浓度有关。拉乌尔定律和亨利定律所描述的就是溶液蒸气压和浓度之间的关系。 3.3.1 拉乌尔定律 1887 年法国物理学家拉乌尔(Raou lt)在溶液蒸气压实验中总结出著名的拉乌尔定律。拉乌尔定律指出:如果溶质是不挥发性的,即它的蒸气压极小,与溶剂相比可以忽略不计,则在一定的温度下,稀溶液的蒸气压等于纯溶剂的蒸气压与其克分子分数的乘积。即 式中 p1--溶剂的蒸气压,溶质是不挥发性时,即为溶液的蒸气压; x 1 ──溶液中溶剂的克分分数。 拉乌尔定律还可以表述为:在一定的温度下,当不挥发物质溶解在溶剂中时,溶液的蒸气压相对下降等于溶质的克分子分数。即 式中 △p— — 溶液的蒸气压下降值; x 2— — 溶质的克分子分数。 对于溶质是挥发性物质,它的蒸气压不能忽略时,拉乌尔定律仍然适用,但要注意此时 p1 是溶液中溶剂的蒸气压。 3.3.2 亨利定律 亨利定律是1803 年由亨利在对气体在液体中溶解度的实验研究中得出的。亨利定律指出:在一定的温度下,气体在液体中的溶解度和该气体的平衡分压成正比。即 p2=kxx2 (3.22) 式中 x2 ──气体溶质在溶液中的克分子分数; p2 ──该气体的平衡分压; kx ──常数。 亨利定律中的浓度单位除可用克分子分数外,也可用其他浓度单位表示,但是采用不同的单位时,常数 k 不同。 亨利定律可以推广到具有挥发性溶质溶于液体的稀溶液。但是需要特别注意的是,亨利定律的应用是有条件的:只有当溶质在液相和在气相里都以相同的质点存在时亨利定律才适用。由于气体在金属中往往以原子状态存在,因此气体在金属中的溶解往往不服从亨利定律。HCl 溶于水,由于 HCl 要分解为 H+和 Cl-离子,也不服从亨利定律。 3.3.3 拉乌尔定律和亨利定律的区别 拉乌尔定律和亨利定律是溶液中两个最基本的经验定律,都表示组元的分压与浓度之间的比例关系。它们的区别在于:(1)拉乌尔定律适用于稀溶液的溶剂和理想溶液,而亨利定律适用于溶质;(2)拉乌尔定律中的比例常数 p1°是纯溶剂...