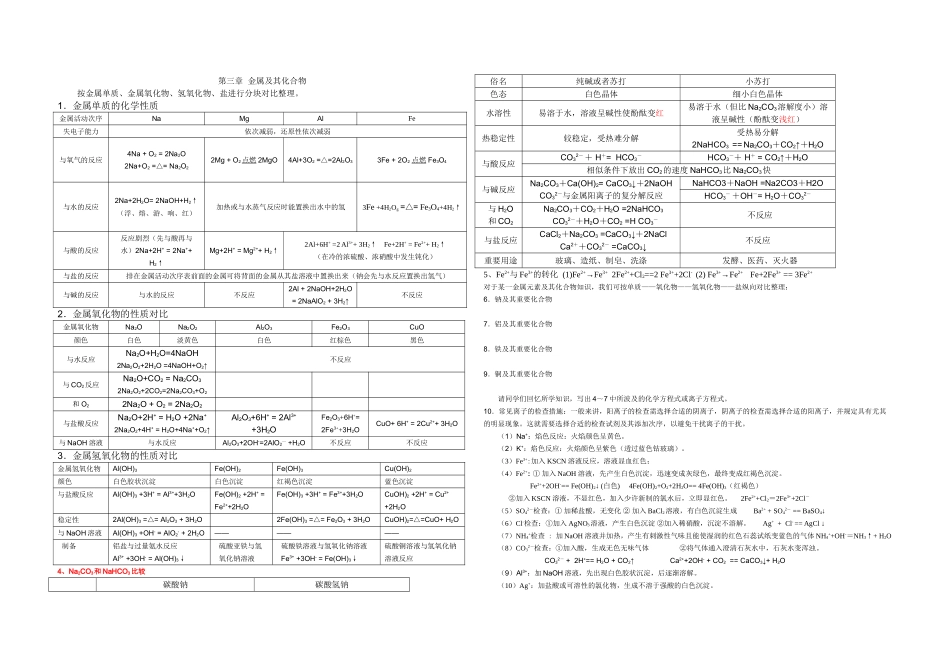
第一章从试验学化学 1.几种常见的混合物的分离和提纯措施措施分离的对象重要仪器应用举例过滤从液体中分离不溶的固体漏斗、滤纸、铁架台(带铁圈)、玻璃棒、烧杯粗盐提纯溶解过滤分离两种固体,一种能溶于某溶剂,另一种则不溶分离食盐和沙蒸发结晶从溶液中分离已溶解的溶质烧杯、玻璃棒、蒸发皿、铁架台(带铁圈)、酒精灯从海水中提取食盐降温结晶分离两种溶解度随温度变化差异较大的溶质氯化钠、硝酸钾混合液的分离分液分离两种不互溶的液体分液漏斗、铁架台(带铁圈)、烧杯分离油和水萃取加入合适溶剂把混合物中某成分溶解及分离用苯提取水溶液中的溴蒸馏运用组分中沸点的不一样进行分离蒸馏烧瓶、冷凝管、锥形瓶、酒精灯、石棉网、铁架台、牛角管、温度计从海水中制取纯水2.化学计量之间的转化关系 (1)理解物质的量及其单位摩尔、摩尔质量、阿伏加德罗常数、气体摩尔体积、物质的量浓度等概念。 (2)以物质的量为关键的计算 n====CB×V (3)有关溶液稀释(稀释前后溶质守恒):C (浓)·V (浓)==C (稀)·V (稀)(4)溶质质量分数(W)与溶质的物质的量浓度(c)的转化:(注意其中的单位换算)阿伏加德罗定律:同温同压下, 相似体积的任何气体都具有相似的分子数3.一定物质的量浓度溶液的配制及误差分析 (1)容量瓶是配制一定物质的量浓度溶液的仪器,其常用规格有 50 mL、100 mL、250 mL、500 mL、1000 mL 等,使用时一定要注意其规格,如 500 mL 容量瓶。并且使用前一定要检查其与否漏水。 (2)配制环节,所用仪器及注意事项配制环节使用仪器注意事项计算——固体求溶质质量,液体求其体积。称量托盘天平或量筒天平的精确度为 0.1 g,量筒的精确度为 0.1 mL,量筒量取液体后不需要洗涤。溶解/稀释烧杯、玻璃棒溶解要在小烧杯中,切不可在容量瓶中直接溶解。冷却——将液体恢复到室温(20℃)转移Xml 容量瓶转移时要用玻璃棒引流,以防液体溅失洗涤——洗烧杯和玻璃棒 2—3 次,并将洗涤液转入容量瓶振荡——使溶液充足混合定容胶头滴管加水至刻度线 1—2 cm 时,用胶头滴管滴加,并使视线、刻度线、凹液面相切。摇匀——两手握住容量瓶,上下颠倒摇匀。装瓶贴签试剂瓶容量瓶不能用于长期贮存溶液。 (3)误差分析 由公式知,但凡溶质的物质的量减少或使溶液体积增大的操作,都会使 c 偏低,反之偏高。第二章 化学物质及其变化1.根据不一样原则可以将化学变化进行分类: ①根据反应前后...