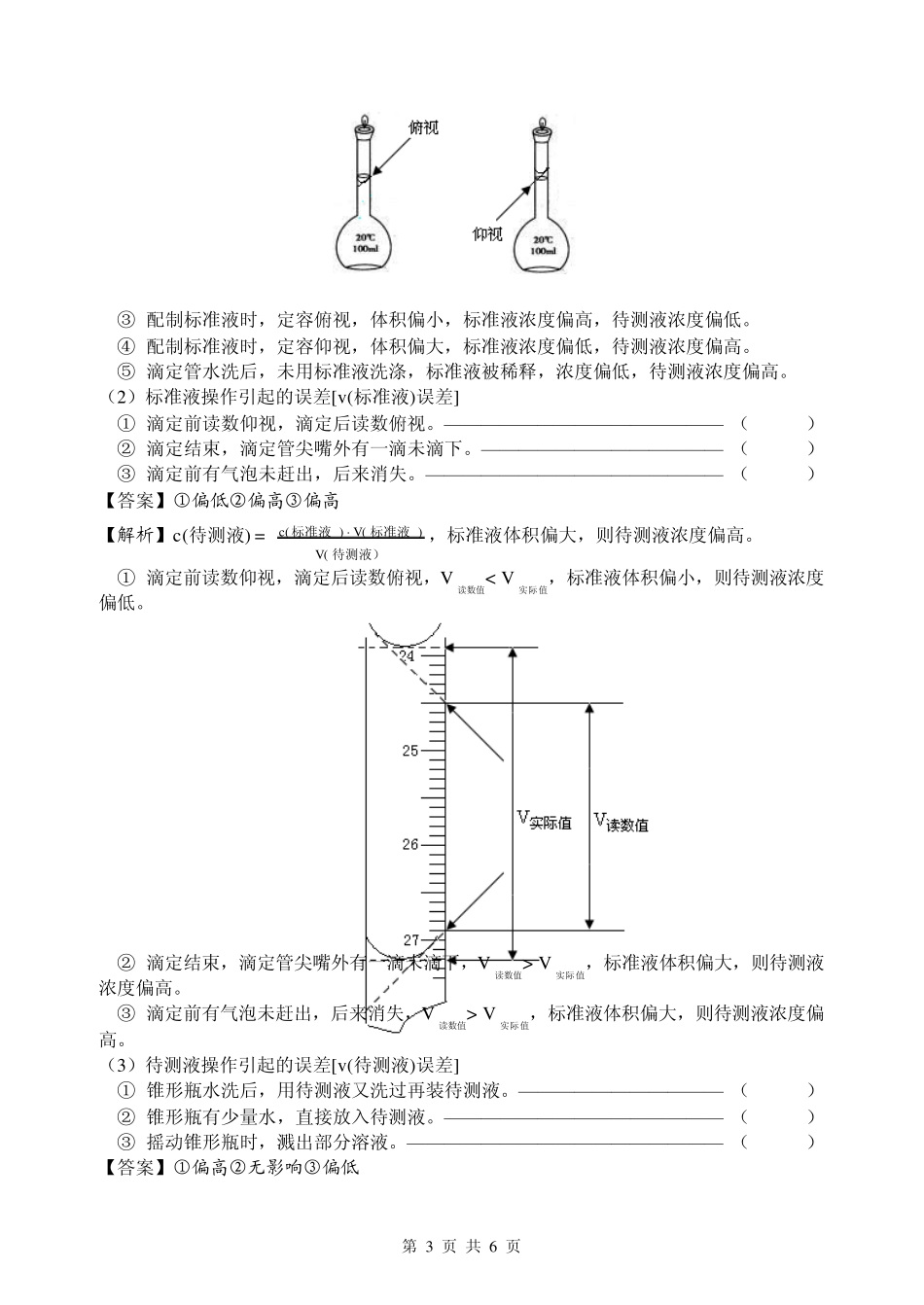
第 1 页 共 6 页 第5 讲 酸碱中和滴定 1.主要仪器 滴定管分为(A)酸式滴定管和(B)碱式滴定管。 酸性溶液装在 酸式 滴定管中, 碱性溶液装在 碱式 滴定管中。 酸、碱式滴定管的构造如图所示,“0”刻度在上,准确度为 0.01 mL。 滴定速度,先 快 后 慢 ,接近滴定终点时,应一滴一摇动。 振荡,半分钟溶液颜色不发生变化,达滴定终点。 例 1.有一支 50 mL 的酸式滴定管,其中盛有溶液,液面恰好在10.00 mL 刻度处,把管中的溶液全部流下排出,承接在量筒中的溶液的体积是 ( ) A.等于 40.00 mL B.等于 10.00 mL C.大于 40.00 mL D.小于 40.00 mL 【答案】C 【解析】滴定管的刻度在中部,“0”刻度在上,量取体积为末初两次读书之差。 2.中和滴定终点判断 (1 )常用的指示剂变色范围: 甲基橙: 红色 3.1 橙色 4.4 黄色 。 酚酞: 无色 8.0 浅红色 10.0 红色 。 石蕊: 红色 5.0 紫色 8.0 蓝色 。 (2 )能用指示剂指示终点的依据 以 0.100 mol·L-1 的NaOH 溶液作标准液滴定20 mL 0.100 mol·L-1 的HCl 为例: ① 滴定前 HCl 溶液中c(H+)是多少?pH 是多少? ② 当滴定NaOH 溶液至 19.98 mL 时,溶液的pH 是多少? ③ 当滴加 NaOH 溶液至 20.02 mL 时,溶液的pH 是多少? 【解析】 第 2 页 共 6 页 ①c(H+)= c(HCl)= 0.100 mol·L-1,pH=-lg0.1=1 ②1510598.192098.190.1-201.0)(LmolHc pH=-lg5×10-5=4.3 ③15-10502.2020200.1-02201.0)O(LmolHc。 110514-102105101)(LmolHc pH=-lg2×10-10=9.7 以酚酞作指示剂,少一滴和多一滴试剂 pH 从 4.3 变到 9.7,颜色从无色突变到红色,误差=%1%100/50201mLmL滴滴,符合分析要求。 3.中和滴定操作:(以标准盐酸滴定 NaOH 溶液为例) (1)准备 ① 滴定管 a.检验酸式滴定管 是否漏夜 。 b.洗涤滴定管后要用 标准盐酸 润洗 2~3 次,并排除滴定管尖嘴处的 气泡 ; c.注入标准液至 “0”刻度上方 2~3cm 处 ; d.将液面调节到 “0”刻度或“0”刻度下 ,记下读数。 ② 锥形瓶:只用 蒸馏水 洗涤,不能用 待测液 润洗。 (2)滴定 ① 用碱式滴定管取一定体积待测液于锥形瓶中,滴入 2~3 滴指示剂。 ② 用 左手 握活塞旋转并关,右手不断...