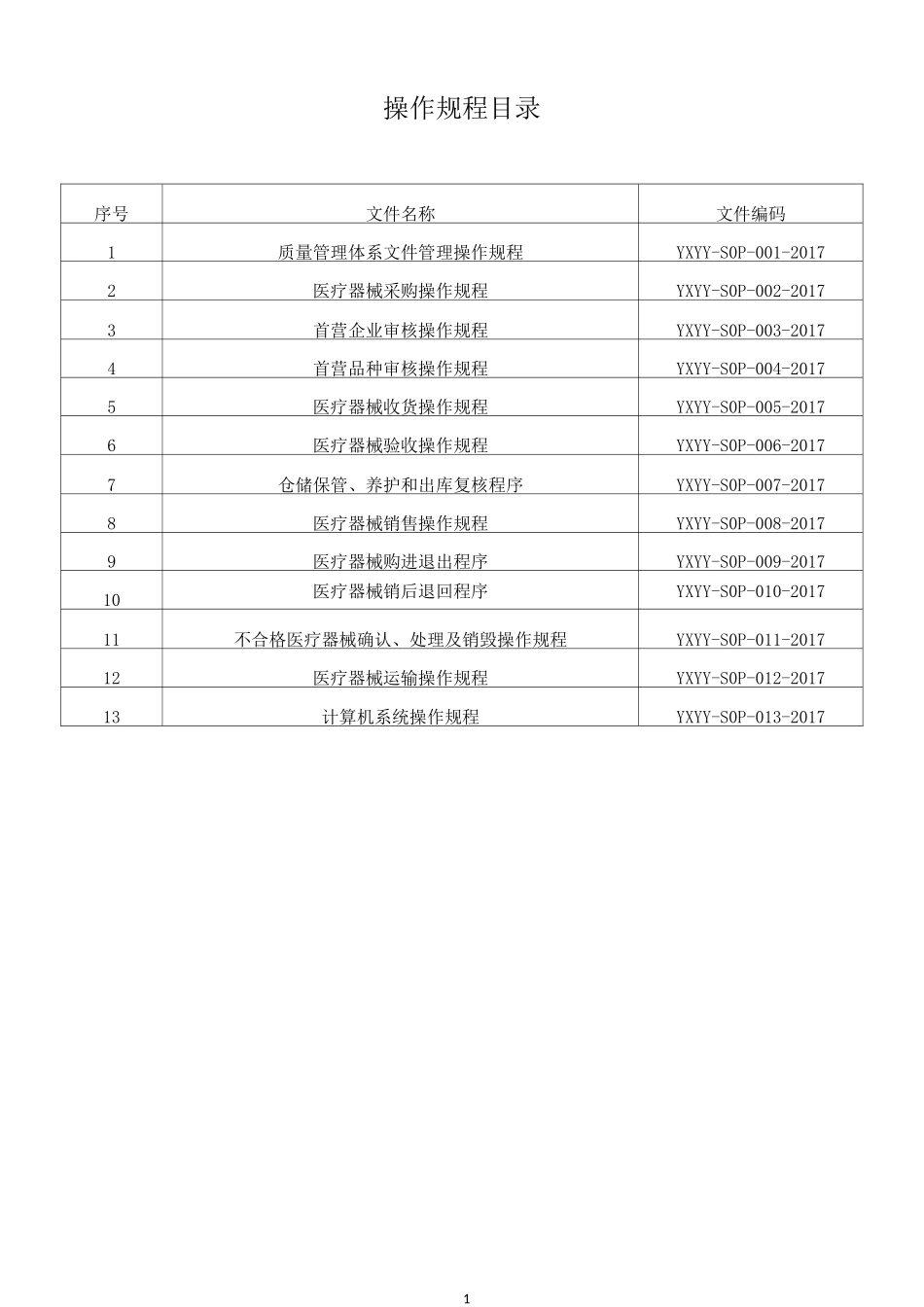
上海裕信医药有限公司操作规程起草人审核人批准人1操作规程目录序号文件名称文件编码1质量管理体系文件管理操作规程YXYY-S0P-001-20172医疗器械采购操作规程YXYY-S0P-002-20173首营企业审核操作规程YXYY-S0P-003-20174首营品种审核操作规程YXYY-S0P-004-20175医疗器械收货操作规程YXYY-S0P-005-20176医疗器械验收操作规程YXYY-S0P-006-20177仓储保管、养护和出库复核程序YXYY-S0P-007-20178医疗器械销售操作规程YXYY-S0P-008-20179医疗器械购进退出程序YXYY-S0P-009-201710医疗器械销后退回程序YXYY-S0P-010-201711不合格医疗器械确认、处理及销毁操作规程YXYY-S0P-011-201712医疗器械运输操作规程YXYY-S0P-012-201713计算机系统操作规程YXYY-S0P-013-2017上海裕信医药有限公司文件235.1.3.2 文件要有较强的可操作性,语言应确切、规范,清晰易懂,不得模棱两可。5.1.3.3文件条理清楚,容易理解,便于使用。有关“要求”的内容应具体,如“定时”,应明确是多长时间,“专人”应明确是谁等。5.1.3.4 需要填写数据的文件,应留有足够的空间,以便于填写内容,每一项的标题应简练、明了。5.2 文件的审核和批准5.2.1 质量负责人对已经起草的文件进行审核。5.2.2 审核的要点5.2.2.1 是否与现行的法律法规相矛盾。5.2.2.2 是否与企业实际相符合。5.2.2.3 是否与企业现行的文件相矛盾。5.2.2.4 文件的意思是否表达完整。5.2.2.5 文件的语句是否通畅。5.2.2.6 文件是否有错别字。5.2.3 文件审核结束后,报企业负责人批准签发,并确定执行日期。5.3 文件培训5.3.1 文件签发后,办公室、质量管理部应组织相关岗位人员学习,涉及到现场操作的需作现场技能培训。5.3.2 对受训人员要建立培训记录和档案。5.3.3 质量管理部应指导、监督文件的执行。5.4 文件的印制、发放、保管5.4.1 企业负责人签发文件后,由办公室负责印制、发放,并负责保管归档,各相关岗位也应保存相关的文件资料。5.4.2 发放文件时,应做好文件发放记录。5.4.3 对修改的文件应加强使用管理,对于已废止的文件版本应及时收回,并作好记录,以防止无效的或作废的文件非预期使用。5.4.4 已废止或者失效的文件除留档备查外,不得在工作现场出现。5.5 文件的检查与考核:按新版医疗器械 GSP 等有关规定,对质量管理制度的执行情况定期进行检查与考核,并有记录。5.6 定期评审:每年对质量管理体系文件进行评审。上海裕信医药有限公司文件45.7 文件的修订5.7.1 质量管...