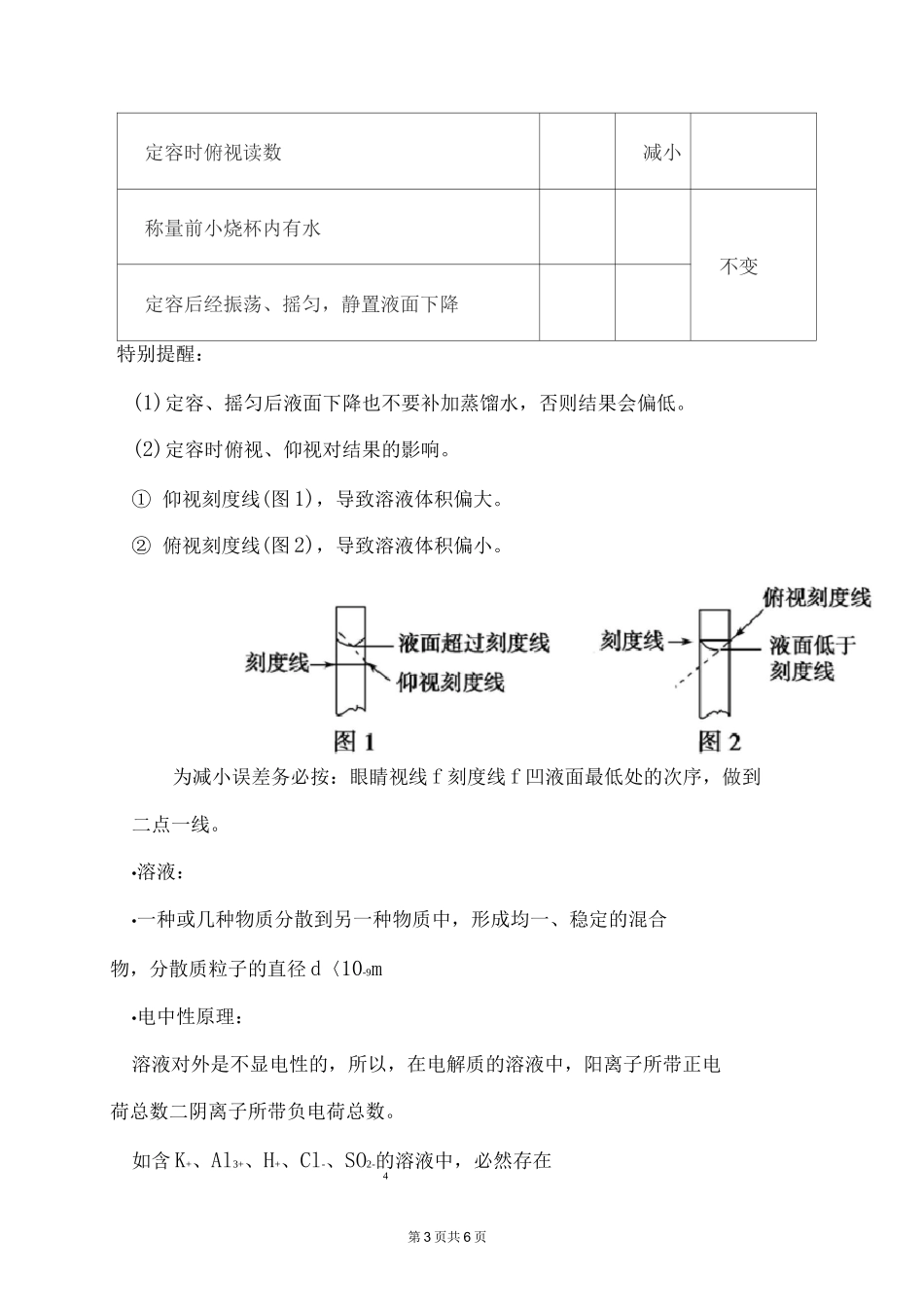
第 1 页共 6 页溶液的稀释定律1.稀释前后溶液中溶质的物质的量不变:c(浓溶液)V(浓溶液)=c(稀溶液)V(稀溶液)2.稀释前后溶液中溶质的质量不变:P(浓溶液)V(浓溶液)w%(浓溶液)=P(稀溶液)V(稀溶液)w%(稀溶液)容量瓶的使用及注意事项(1)在使用前首先要检查是否漏水。具体操作如下:加水 f 倒立 f 观察是否漏水 f 正立—瓶塞旋转倒立—观察是否漏水(2)检查合格后,用蒸馏水洗涤干净。⑶ 四个“不能”①不能将固体或浓溶液直接在容量瓶中溶解或稀释。②不能作为反应容器或长期贮存溶液。③容量瓶的容积是在瓶身所标温度下确定的,因而不能将过冷或过热的溶液转移到容量瓶中。④只能配制容量瓶上规定容积的溶液,即不能配制任意体积的溶液。2.误差分析第 2 页共 6 页分析依据 2 君価,以配置 NaOH 溶液为例,在进行误差分析时,根据实验操作弄清是“m”还是“V”引起的误差,再具体分析,具体情况如下:能引起误差的一些操作因变量c(mol/L)mV袪码与物品颠倒(使用游码)减小偏低称量时间过长减小用滤纸称 NaOH减小向容量瓶注液时少量溅出减小未洗涤烧杯和玻璃棒减小定容时,水多用滴管吸出减小定容摇匀后液面下降再加水增大定容时仰视刻度线增大袪码沾有其他物质或已生锈增大偏髙未冷却至室温就注入容量瓶定容减小第 3 页共 6 页定容时俯视读数减小称量前小烧杯内有水不变定容后经振荡、摇匀,静置液面下降特别提醒:(1)定容、摇匀后液面下降也不要补加蒸馏水,否则结果会偏低。(2)定容时俯视、仰视对结果的影响。① 仰视刻度线(图 1),导致溶液体积偏大。② 俯视刻度线(图 2),导致溶液体积偏小。为减小误差务必按:眼睛视线 f 刻度线 f 凹液面最低处的次序,做到二点一线。•溶液:•一种或几种物质分散到另一种物质中,形成均一、稳定的混合物,分散质粒子的直径 d〈10-9m•电中性原理:溶液对外是不显电性的,所以,在电解质的溶液中,阳离子所带正电荷总数二阴离子所带负电荷总数。如含 K+、Al3+、H+、Cl-、SO2-的溶液中,必然存在4第 4 页共 6 页c(K+)+3c(Ah+)+c(H+)=c(Cl-)+2c(S02-)。4•一定物质的量浓度的溶液的配置:1•主要仪器(1)托盘天平:可精确至 0.1g,称量前先调零,称量时物品放在左盘,袪码放在右盘。(2)容量瓶:配制溶液的专用精确容器,瓶上标有温度、容积和刻度线。(3)其他仪器:量筒、烧杯、玻璃棒、胶头滴管等。2•配制过程配制过程如下:称量、溶解、冷却移液、...