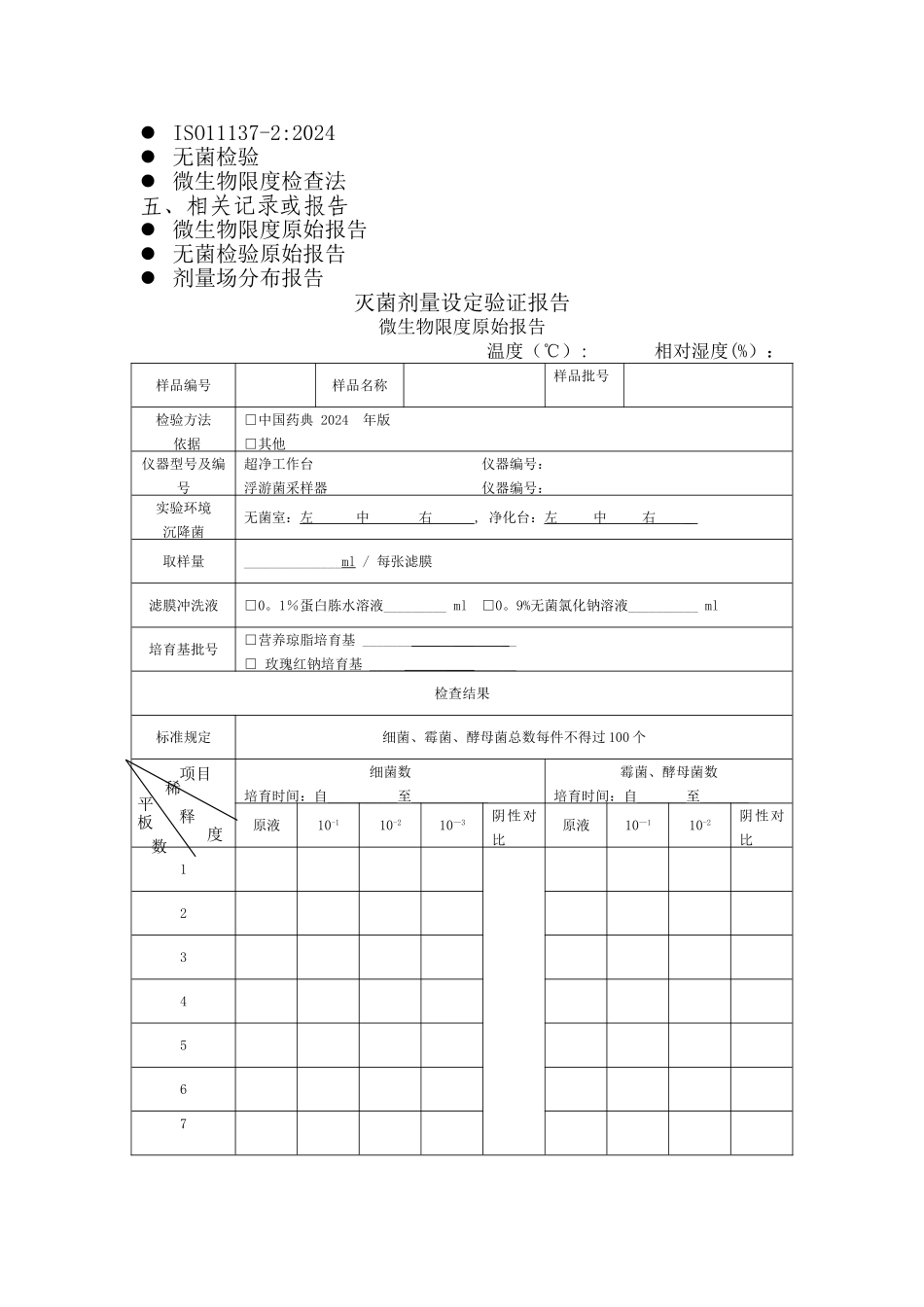
上海晟实医疗器械科技有限公司灭菌剂量设定验证方案2024 年 7 月上海晟实医疗器械科技有限公司灭菌剂量设定验证方案一、灭菌剂量设定的目的依据 ISO11137—2:2024 的 VDmax25 方法对我司的钴铬钼及钛合金材质的产品实施辐照灭菌过程,建立灭菌剂量,并验证灭菌剂量.二、验证小组成员及设备的认可1、验证小组成员权利及职责相关负责人职能部门职责签字批准方案和报告技术部起草、编制方案、形成报告; 质量部负责依据方案准备验证用材料;审核验证方案,收集并审核化验报告;根据方案实施验证.生产部对验证各步审核指导,负责整个验证的协调工作2、相关设备的认可所有相关设备的使用必须经过校准或检定。三、验证实施方案编制:技术部 审核: 批准: 日期:2024 年 7 月 日期: 日期: 1、生物负载实验方法生物负载数据采纳经过回收率校正的平板计数结果.平板计数的方法采纳《中华人民共和国药典》2024版的附录微生物限度检查法(详见文件《微生物限度检查法》。2、建立灭菌剂量 VDmax25 的方法依据ISO11137-2:2024中的条款9的VDmax25方法建立灭尽剂量,至少需要样品53件。取样方法是首先随机抽取连续3批常规生产的产品作为样品,每批13件,再从抽取的样品中的每批中取3件,3批共9件用于样品回收率实验;其余的30件样品做生物负载检测,得到的平均生物负载为最终用于确定验证剂量的结果。用最终生物负载结果查ISO11137—2:2024的表9,得相应的验证剂量VDmax(—1)法,用此次验证剂量辐照与以上3批抽样产品连续生产的10件样品,分别用经过验证的无菌试样方法进行无菌试验,观察实验结果,并记录阳性数。假如阳性数未超过1个,则25 KGy的灭菌剂量得到验证。3、无菌试验无菌试验应符合ISO11737—2:2024(《Sterilization of medical devices-Microbiological methods—Part2 Test of sterility performed in the validation of a sterilization process》)的要求,无菌试验所用的方法应经过验证试验的验证,具体实施根据文件《无菌检验》操作。4、剂量设定实验结果判定对用验证剂量辐照过的10 件产品做无菌实验,依照ISO11137-2:2024 条款9。2.6 推断无菌实验是否被接受,无菌试验的阳性数量不大于1个,无菌实验成功,即:验证剂量被接受,证实25kGy 能够满足10-6 的无菌保证水平。当无菌实验的阳性结果高于1个,实验失败,即:依照这个方法不能建立灭菌剂量。应考虑使用其他方法设定剂量。5、剂量场分布由灭菌供方...