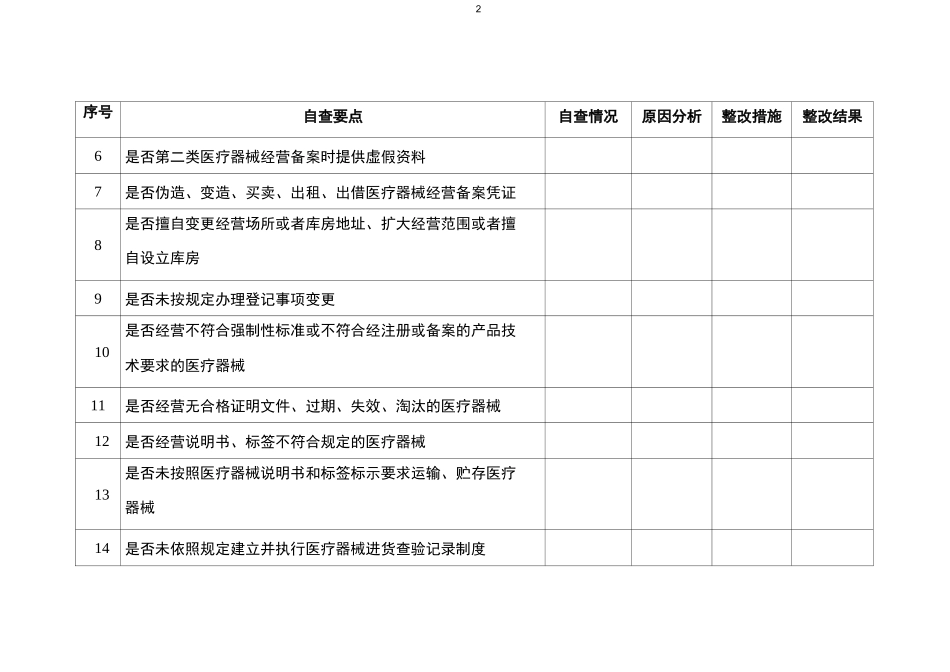
1附件 22019 年无菌和植入性医疗器械经营企业自查要点企业名称(盖章):序号自查要点自查情况原因分析整改措施整改结果1是否未经许可经营第二类医疗器械2是否经营未取得医疗器械注册证的第二类、第二类医疗器械3是否提供虚假资料或米取其他欺骗手段取得医疗器械经营许可证4是否伪造、变造、买卖、出租、出借医疗器械经营许可证5是否未按规定备案经营第二类医疗器械2序号自查要点自查情况原因分析整改措施整改结果6是否第二类医疗器械经营备案时提供虚假资料7是否伪造、变造、买卖、出租、出借医疗器械经营备案凭证8是否擅自变更经营场所或者库房地址、扩大经营范围或者擅自设立库房9是否未按规定办理登记事项变更10是否经营不符合强制性标准或不符合经注册或备案的产品技术要求的医疗器械11是否经营无合格证明文件、过期、失效、淘汰的医疗器械12是否经营说明书、标签不符合规定的医疗器械13是否未按照医疗器械说明书和标签标示要求运输、贮存医疗器械14是否未依照规定建立并执行医疗器械进货查验记录制度3序号自查要点自查情况原因分析整改措施整改结果15是否从事第二类、第二类医疗器械批发业务以及第二类医疗器械零售业务的经营企业未依照规定建立并执行销售记录制度16是否派出销售人员销售医疗器械,未按要求提供授权书17经营条件发生变化,不再符合医疗器械经营质量管理规范要求,是否未按照规定进行整改18是否从不具有资质的生产、经营企业购进医疗器械19监管部门责令实施召回或停止经营后,是否拒不停止经营(召回)医疗器械4序号自查要点自查情况原因分析整改措施整改结果20是否未开展医疗器械不良事件监测21企业质量负责人是否负责医疗器械质量管理工作,独立履行职责,在企业内部对医疗器械质量管理具有裁决权,承担相应的质量管理责任。22企业质量管理机构或者质量管理人员是否全面履行职责。23企业是否依据《医疗器械经营质量管理规范》建立覆盖医疗器械经营全过程的质量管理制度拼保存相关记录或者档案。24从事第二类、第二类医疗器械批发业务和第二类医疗器械零售业务的企业开展购货者资格审核、医疗器械追踪溯源情况。25第—类医疗器械经营企业是否建立质量管理自查制度,是否于每年年底前向所在地设区的负责医疗器械监督管理的部门提交年度自查报告。5序号自查要点自查情况原因分析整改措施整改结果26进货查验记录和销售记录是否保存至医疗器械有效期后 2 年;无有效期的,不得少于 5 年。植入类医疗器械进货查验记录和销售...