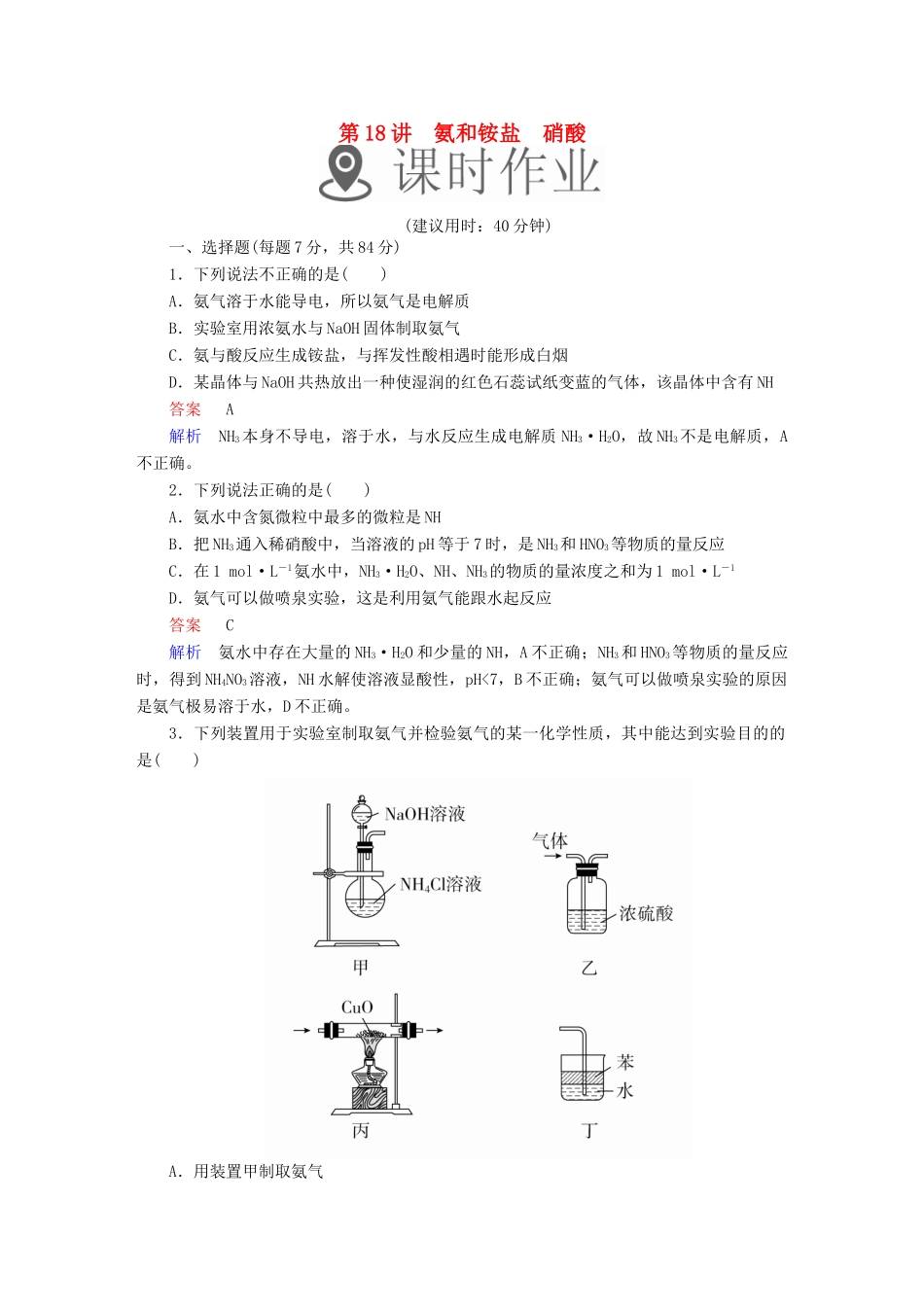
第18讲氨和铵盐硝酸(建议用时:40分钟)一、选择题(每题7分,共84分)1.下列说法不正确的是()A.氨气溶于水能导电,所以氨气是电解质B.实验室用浓氨水与NaOH固体制取氨气C.氨与酸反应生成铵盐,与挥发性酸相遇时能形成白烟D.某晶体与NaOH共热放出一种使湿润的红色石蕊试纸变蓝的气体,该晶体中含有NH答案A解析NH3本身不导电,溶于水,与水反应生成电解质NH3·H2O,故NH3不是电解质,A不正确。2.下列说法正确的是()A.氨水中含氮微粒中最多的微粒是NHB.把NH3通入稀硝酸中,当溶液的pH等于7时,是NH3和HNO3等物质的量反应C.在1mol·L-1氨水中,NH3·H2O、NH、NH3的物质的量浓度之和为1mol·L-1D.氨气可以做喷泉实验,这是利用氨气能跟水起反应答案C解析氨水中存在大量的NH3·H2O和少量的NH,A不正确;NH3和HNO3等物质的量反应时,得到NH4NO3溶液,NH水解使溶液显酸性,pH<7,B不正确;氨气可以做喷泉实验的原因是氨气极易溶于水,D不正确。3.下列装置用于实验室制取氨气并检验氨气的某一化学性质,其中能达到实验目的的是()A.用装置甲制取氨气B.用装置乙除去氨气中的水蒸气C.用装置丙验证氨气具有还原性D.用装置丁吸收氨气答案C解析氨气极易溶于水,氢氧化钠溶液与氯化铵溶液反应生成氯化钠、一水合氨,得不到氨气,A错误;氨气为碱性气体,不能用浓硫酸干燥,B错误;氨气与氧化铜反应生成铜、氮气和水,观察试管中固体颜色变化,即可验证氨气具有还原性,C正确;水的密度大于苯,氨气极易溶于水,不能防止倒吸的发生,应将苯换成四氯化碳,D错误。4.为了简便地制取干燥、纯净的氨气,下列说法正确的是()A.氯化铵与氢氧化钠溶液共热,生成的气体用碱石灰干燥B.N2与H2化合生成NH3,用烧碱干燥C.加热浓氨水,气体用碱石灰干燥D.加热分解NH4Cl答案C解析制取氨气的实验室制法一般是用氯化铵与氢氧化钙固体粉末共热,不能使用氢氧化钠溶液,因氨气极易溶于水,A错;N2与H2反应是工业上合成氨,条件是高温、高压、催化剂,B错;NH4Cl受热分解后,遇冷又会重新化合生成氯化铵,D错。5.下图是课外活动小组的同学设计的4个喷泉实验方案,下列有关操作不可能引发喷泉现象的是()A.挤压装置①的胶头滴管使CCl4全部进入烧瓶,片刻后打开止水夹B.挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹C.用鼓气装置从装置③的a处不断鼓入空气并打开止水夹D.向装置④的水槽中慢慢加入足量浓硫酸并打开止水夹答案B解析H2难溶于NaOH溶液,不能形成较大压强差,不能引发喷泉现象。6.将相同质量的铜分别与足量的浓硝酸、稀硝酸反应,下列叙述正确的是()A.硝酸浓度越大消耗的硝酸越少,产生的有毒气体也越少B.反应中转移的电子总数稀硝酸少C.试管内壁上的铜用浓硝酸除好,因反应速率快D.两者用排水法收集的气体的体积相同答案D解析由3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O,Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,等量的Cu与硝酸反应,浓硝酸消耗的多,生成的有毒气体多,故A错误;等量的铜与硝酸反应,生成的Cu(NO3)2的物质的量相同,由Cu元素的化合价变化可知,转移电子数相同,故B错误;等量的Cu与硝酸反应,消耗的稀硝酸少,则试管内壁上的铜用稀硝酸除好,故C错误;因3NO2+H2O===2HNO3+NO,最终收集气体均为NO,由电子守恒可知,收集NO的体积相等,所以D项正确,故选D。7.下列说法正确的是()A.向盛有Fe(NO3)2溶液的试管中加入稀硫酸,在管口观察到红棕色气体,是HNO3分解生成了NO2B.可用浓硝酸除去铁表面的镀层银或铜C.1.0mol·L-1的KNO3溶液中可大量存在H+、Fe2+、I-、Cl-、SOD.硫化铜溶于硝酸的离子方程式为CuS+2H+===H2S↑+Cu2+答案B解析Fe2+与NO、H+反应生成NO,NO与空气中的O2反应生成NO2,A项错误;常温下,银、铜可与浓硝酸反应,铁遇浓硝酸钝化,B项正确;Fe2+、I-具有还原性,与NO、H+不能大量共存,C项错误;CuS与HNO3发生氧化还原反应不会生成H2S,D项错误。8.无色的混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100mL甲气体经过如图所示实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为()A...