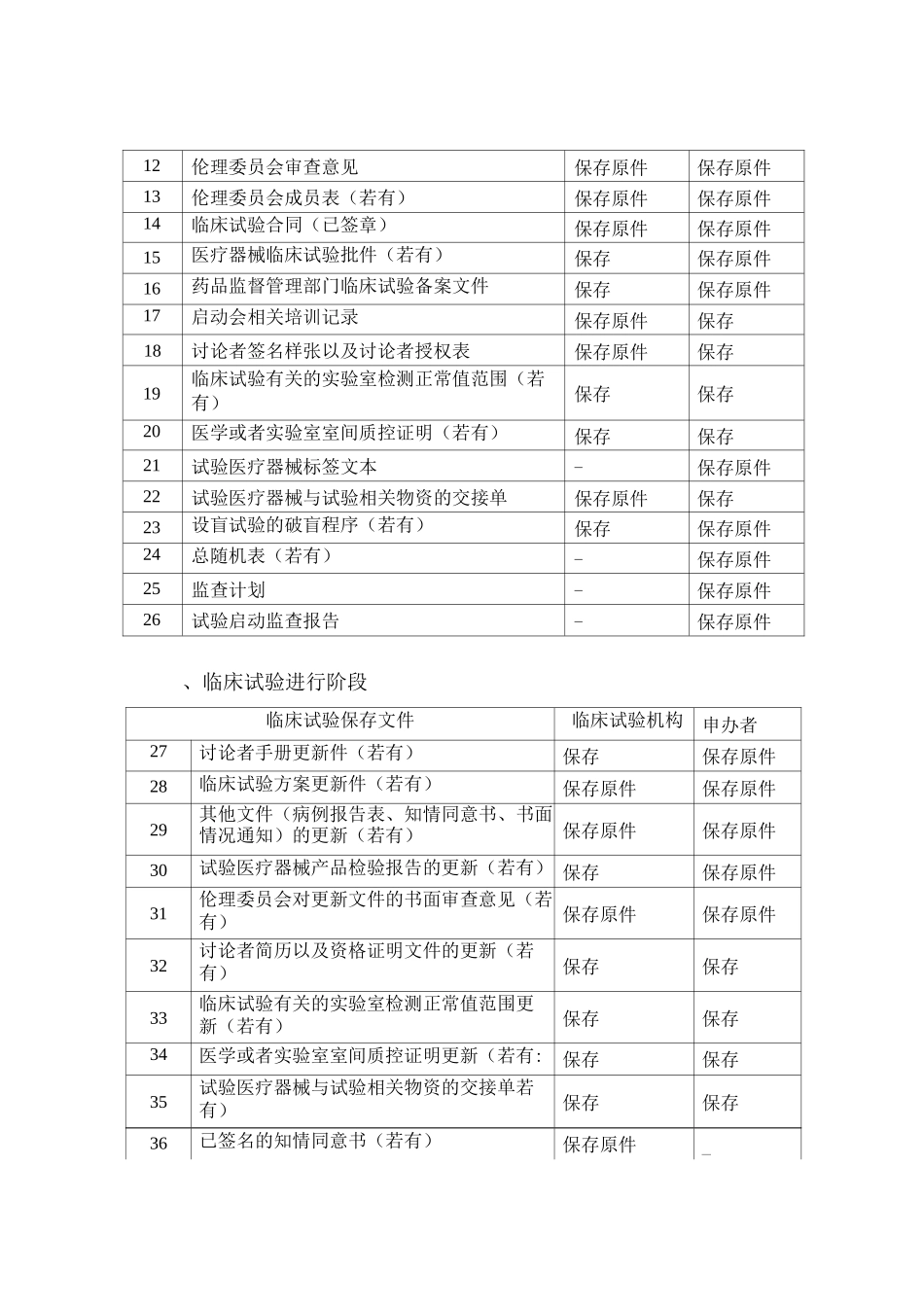
附件 6医疗器械/体外诊断试剂临床试验基本文件目录为指导申办者和医疗器械临床试验机构开展医疗器械(含体外诊断试 剂,下同)临床试验,特制定本文件目录供参考执行。医疗器械临床试验开展顺序一般为:申办者完成临床前相关讨论,选 择已备案的医疗器械临床试验机构以及主要讨论者,并组织临床试验方案 等相关文件制定。伦理委员会审查批准该临床试验,申办者与临床试验机 构签订合同后进行医疗器械临床试验项目备案;其中,对人体具有较高风 险的第三类医疗器械临床试验,还应当经国务院药品监督管理部门批准。 受试者签署知情同意书以及入组,讨论者根据临床试验方案实施临床试 验。申办者在临床试验完成后向所在地省局报告。一、临床试验准备阶段临床试验保存文件临床试验机构申办者1临床试验申请表保存原件保存2试验方案以及其修正案(已签章)保存原件保存原件3讨论者手册保存保存原件4知情同意书文本以及其他任何提供给受试者 的书面材料保存原件保存原件5招募受试者和向其宣传的程序性文件(若有: 保存原件保存原件6病例报告表文本保存原件保存原件7基于产品技术要求的产品检验报告保存保存原件8临床前讨论相关资料保存保存原件9讨论者简历以及资格证明文件保存保存10试验医疗器械的研制符合适用的医疗器械质 量管理体系相关要求的声明保存保存原件11受试者保险的相关文件(若有)保存保存原件12伦理委员会审查意见保存原件保存原件13伦理委员会成员表(若有)保存原件保存原件14临床试验合同(已签章)保存原件保存原件15医疗器械临床试验批件(若有)保存保存原件16药品监督管理部门临床试验备案文件保存保存原件17启动会相关培训记录保存原件保存18讨论者签名样张以及讨论者授权表保存原件保存19临床试验有关的实验室检测正常值范围(若 有)保存保存20医学或者实验室室间质控证明(若有)保存保存21试验医疗器械标签文本-保存原件22试验医疗器械与试验相关物资的交接单保存原件保存23设盲试验的破盲程序(若有)保存保存原件24总随机表(若有)-保存原件25监查计划-保存原件26试验启动监查报告-保存原件、临床试验进行阶段临床试验保存文件临床试验机构申办者27讨论者手册更新件(若有)保存保存原件28临床试验方案更新件(若有)保存原件保存原件29其他文件(病例报告表、知情同意书、书面 情况通知)的更新(若有)保存原件保存原件30试验医疗器械产品检验报告的更新(若有) 保存保存原件31伦理委员会对更新文件的书...