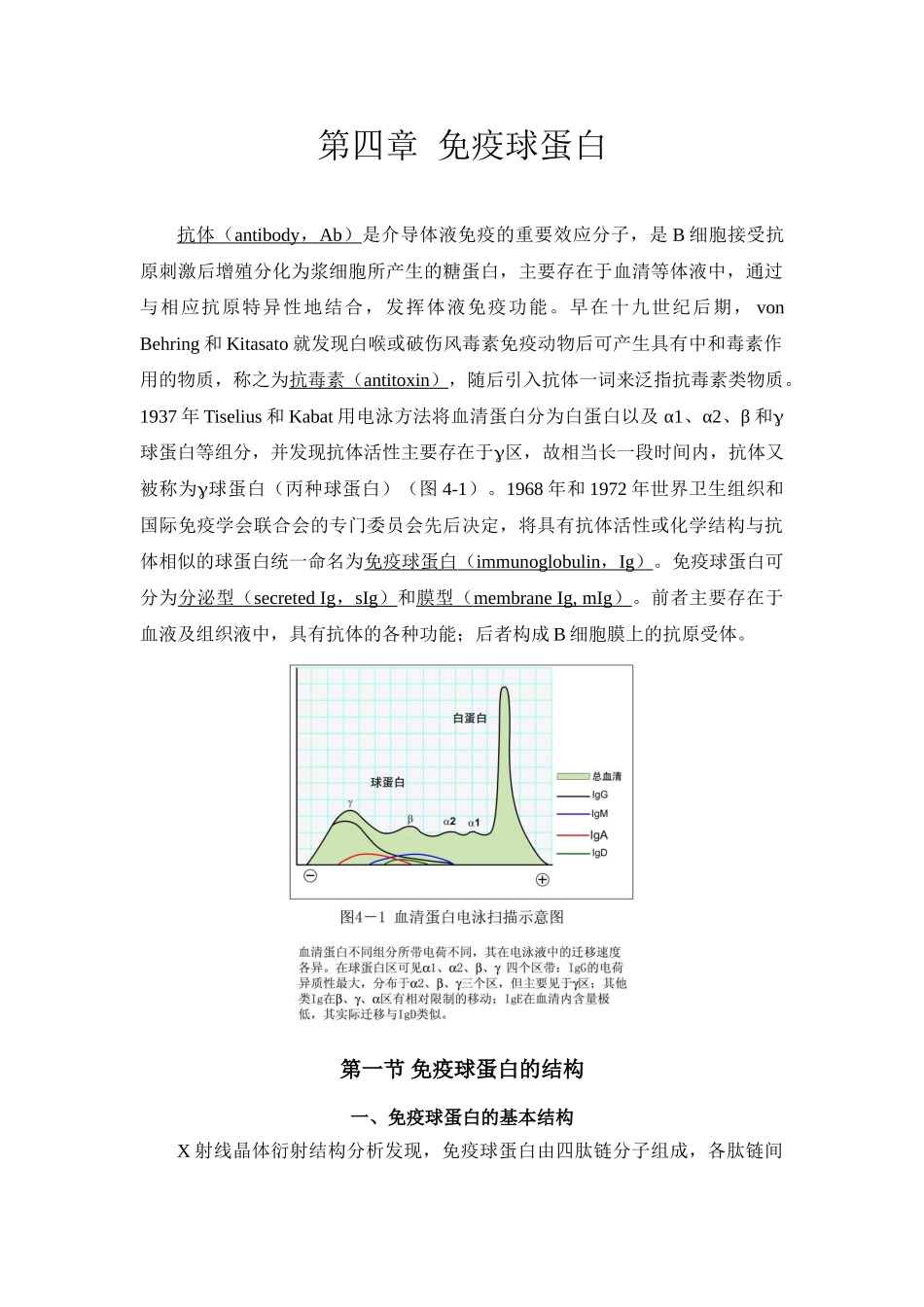
第四章 免疫球蛋白抗体 ( antibody , Ab ) 是介导体液免疫的重要效应分子,是 B 细胞接受抗原刺激后增殖分化为浆细胞所产生的糖蛋白,主要存在于血清等体液中,通过与相应抗原特异性地结合,发挥体液免疫功能。早在十九世纪后期, von Behring 和 Kitasato 就发现白喉或破伤风毒素免疫动物后可产生具有中和毒素作用的物质,称之为抗毒素( antitoxin ) ,随后引入抗体一词来泛指抗毒素类物质。1937 年 Tiselius 和 Kabat 用电泳方法将血清蛋白分为白蛋白以及 α1、α2、β 和球蛋白等组分,并发现抗体活性主要存在于区,故相当长一段时间内,抗体又被称为球蛋白(丙种球蛋白)(图 4-1)。1968 年和 1972 年世界卫生组织和国际免疫学会联合会的专门委员会先后决定,将具有抗体活性或化学结构与抗体相似的球蛋白统一命名为免疫球蛋白 ( immunoglobulin , Ig ) 。免疫球蛋白可分为分泌型( secreted Ig , sIg ) 和膜型( membrane Ig, mIg ) 。前者主要存在于血液及组织液中,具有抗体的各种功能;后者构成 B 细胞膜上的抗原受体。第一节 免疫球蛋白的结构一、免疫球蛋白的基本结构X 射线晶体衍射结构分析发现,免疫球蛋白由四肽链分子组成,各肽链间有数量不等的链间二硫键。在结构上 Ig 可分为三个大小大致相同的片段,其中两个大小完全一致的片段位于分子的上方,通过一易弯曲的区域与主干连接,形成一“Y”字型结构(图 4-2),组成 Ig 单体,是免疫球蛋白分子的基本单位。(一)重链和轻链任何一类天然免疫球蛋白分子均含有四条多肽链,其中,分子量较大的称为重链 (heavy chain , H) ,而分子量较小的为轻链 (light chain , L) 。同一天然 Ig分子中的两条 H 链和两条 L 链的氨基酸组成完全相同。1.重链 分子量约为 50~75kD,由 450~550 个氨基酸残基组成。各类免疫球蛋白重链恒定区的氨基酸组成和排列顺序不尽相同,因而其抗原性也不同。据此,可将免疫球蛋白重链分为五类( class ) 或五个同种型( isotype ) ,即 μ链、δ 链、链、α 链和 ε 链,其相应的 Ig 分别为 IgM、IgD、IgG、IgA 和 IgE。不同类的重链具有不同的特征,如链内二硫键的数目和位置、连接寡糖的数量、结构域的数目以及铰链区的长度等均不完全相同。即使是同一类 Ig 重链其铰链区氨基酸组成和二硫键的数目、位置也不同,据此又可将同一类 Ig 分...