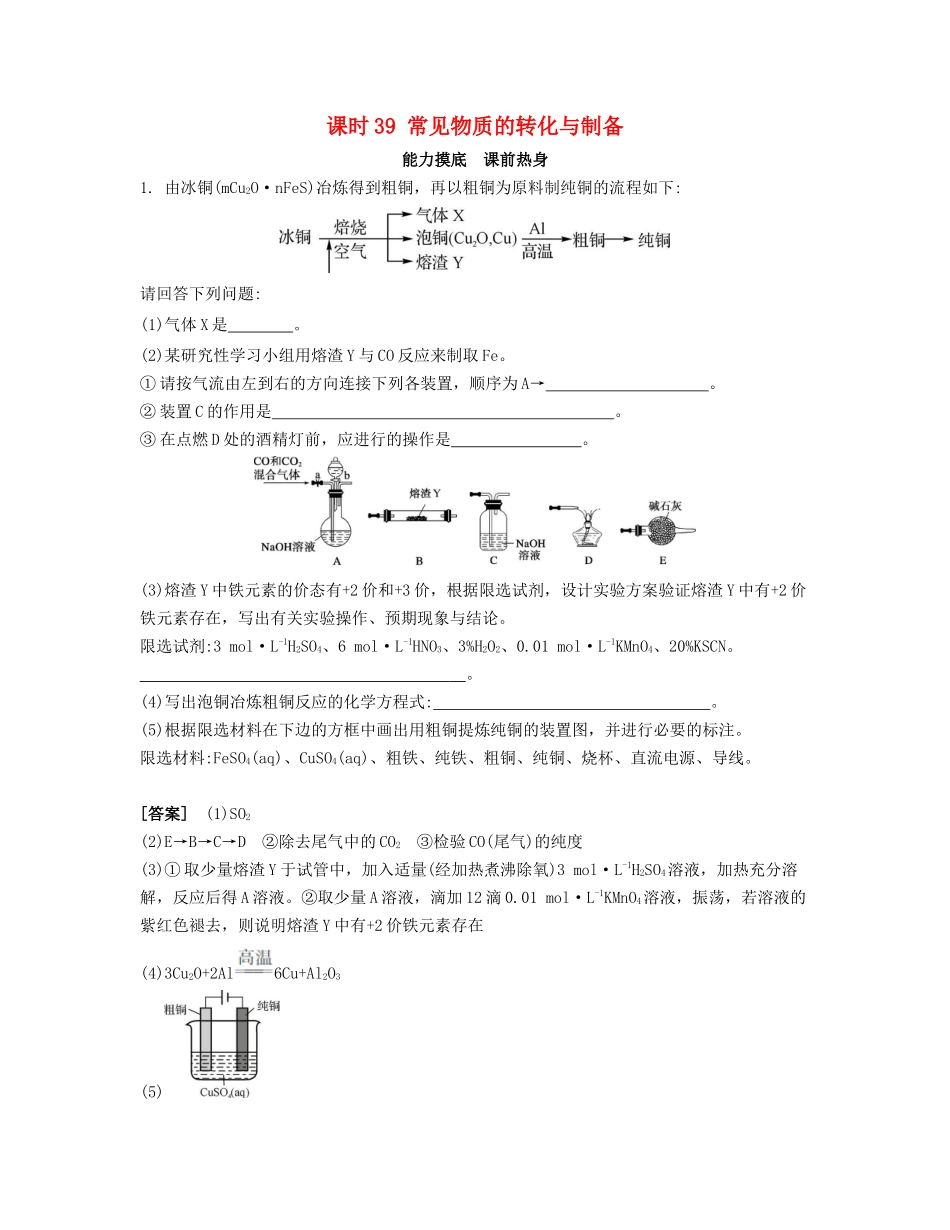
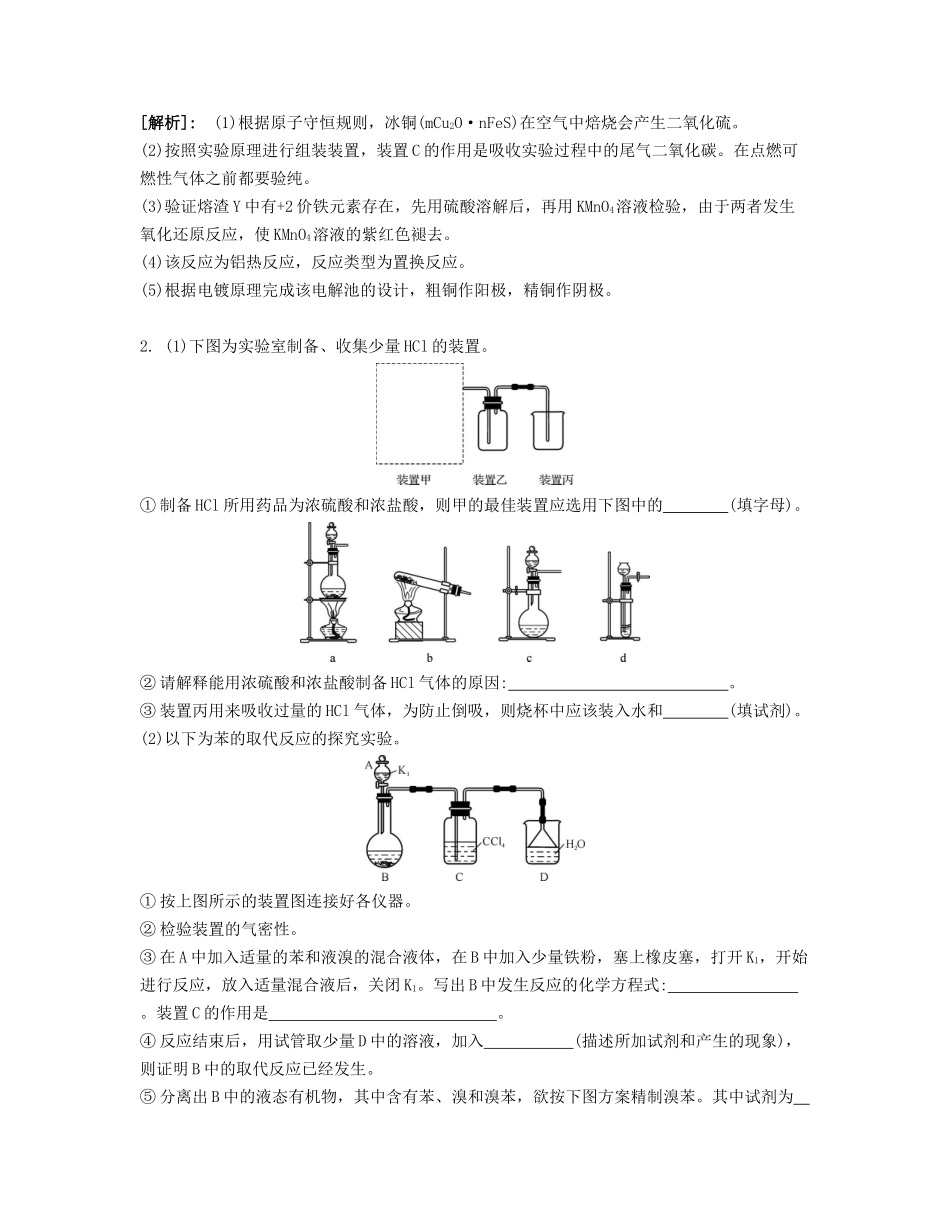
课时39常见物质的转化与制备能力摸底课前热身1.由冰铜(mCu2O·nFeS)冶炼得到粗铜,再以粗铜为原料制纯铜的流程如下:请回答下列问题:(1)气体X是。(2)某研究性学习小组用熔渣Y与CO反应来制取Fe。①请按气流由左到右的方向连接下列各装置,顺序为A→。②装置C的作用是。③在点燃D处的酒精灯前,应进行的操作是。(3)熔渣Y中铁元素的价态有+2价和+3价,根据限选试剂,设计实验方案验证熔渣Y中有+2价铁元素存在,写出有关实验操作、预期现象与结论。限选试剂:3mol·L-1H2SO4、6mol·L-1HNO3、3%H2O2、0.01mol·L-1KMnO4、20%KSCN。。(4)写出泡铜冶炼粗铜反应的化学方程式:。(5)根据限选材料在下边的方框中画出用粗铜提炼纯铜的装置图,并进行必要的标注。限选材料:FeSO4(aq)、CuSO4(aq)、粗铁、纯铁、粗铜、纯铜、烧杯、直流电源、导线。[答案](1)SO2(2)E→B→C→D②除去尾气中的CO2③检验CO(尾气)的纯度(3)①取少量熔渣Y于试管中,加入适量(经加热煮沸除氧)3mol·L-1H2SO4溶液,加热充分溶解,反应后得A溶液。②取少量A溶液,滴加12滴0.01mol·L-1KMnO4溶液,振荡,若溶液的紫红色褪去,则说明熔渣Y中有+2价铁元素存在(4)3Cu2O+2Al6Cu+Al2O3(5)[解析]:(1)根据原子守恒规则,冰铜(mCu2O·nFeS)在空气中焙烧会产生二氧化硫。(2)按照实验原理进行组装装置,装置C的作用是吸收实验过程中的尾气二氧化碳。在点燃可燃性气体之前都要验纯。(3)验证熔渣Y中有+2价铁元素存在,先用硫酸溶解后,再用KMnO4溶液检验,由于两者发生氧化还原反应,使KMnO4溶液的紫红色褪去。(4)该反应为铝热反应,反应类型为置换反应。(5)根据电镀原理完成该电解池的设计,粗铜作阳极,精铜作阴极。2.(1)下图为实验室制备、收集少量HCl的装置。①制备HCl所用药品为浓硫酸和浓盐酸,则甲的最佳装置应选用下图中的(填字母)。②请解释能用浓硫酸和浓盐酸制备HCl气体的原因:。③装置丙用来吸收过量的HCl气体,为防止倒吸,则烧杯中应该装入水和(填试剂)。(2)以下为苯的取代反应的探究实验。①按上图所示的装置图连接好各仪器。②检验装置的气密性。③在A中加入适量的苯和液溴的混合液体,在B中加入少量铁粉,塞上橡皮塞,打开K1,开始进行反应,放入适量混合液后,关闭K1。写出B中发生反应的化学方程式:。装置C的作用是。④反应结束后,用试管取少量D中的溶液,加入(描述所加试剂和产生的现象),则证明B中的取代反应已经发生。⑤分离出B中的液态有机物,其中含有苯、溴和溴苯,欲按下图方案精制溴苯。其中试剂为,操作名称为。[答案](1)①c②浓硫酸具有强吸水性,吸收了浓盐酸中的水,同时放出大量的热,促进了HCl气体的挥发,所以可以用浓硫酸和浓盐酸制备HCl气体③CCl4(2)③吸收溴和苯的蒸气④少量AgNO3溶液,如果有淡黄色沉淀生成⑤NaOH溶液(或NaSO3溶液)分馏(或蒸馏)[解析]:(1)制备HCl所用药品采用浓硫酸和浓盐酸,原理为浓硫酸滴入到浓盐酸中,利用浓硫酸的吸水性使得浓盐酸挥发出HCl,故选用的装置为c;装置丙用来吸收过量的HCl气体,为防止倒吸,则烧杯中应该装入水和四氯化碳。(2)③苯与溴水发生取代反应生成溴苯和溴化氢,装置C中装有CCl4的作用是吸收溴和苯的蒸气;④反应结束后,D中的溶液中含有HBr,检验的方法是加入少量AgNO3溶液,如果有淡黄色沉淀生成,则证明B中的取代反应已经发生。⑤B中的液态有机物,其中含有苯、溴和溴苯,精制溴苯需要用NaOH溶液除去溴,然后采用分馏的方法分离溴苯、水溶液和苯。3.为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下:请回答:(1)绿矾的化学式为。(2)写出反应①的化学方程式:,反应②生成沉淀的离子方程式为。(3)为了检测滤液D中含有的金属离子,可设计实验方案(试剂自选):。(4)在滤渣B中滴加稀硫酸时,发现反应速率比一般的铁粉反应要快,其原因是。(5)若考虑绿色化学工艺,在滤渣E中加入稀硫酸和试剂Y制胆矾晶体,试剂Y为无色液体,则反应④的总化学方程式为;若不考虑绿色化学工艺,所选试剂Y为1mol·L-1硝酸,欲使3molCu全部溶解且溶液中含铜元素的溶质仅为CuSO4,则需该硝酸的体积为L。[答案](1)FeSO4·7H2O(2)2Al+2NaOH+2H2O2NaAlO2+3H2↑Al+CO2+2...