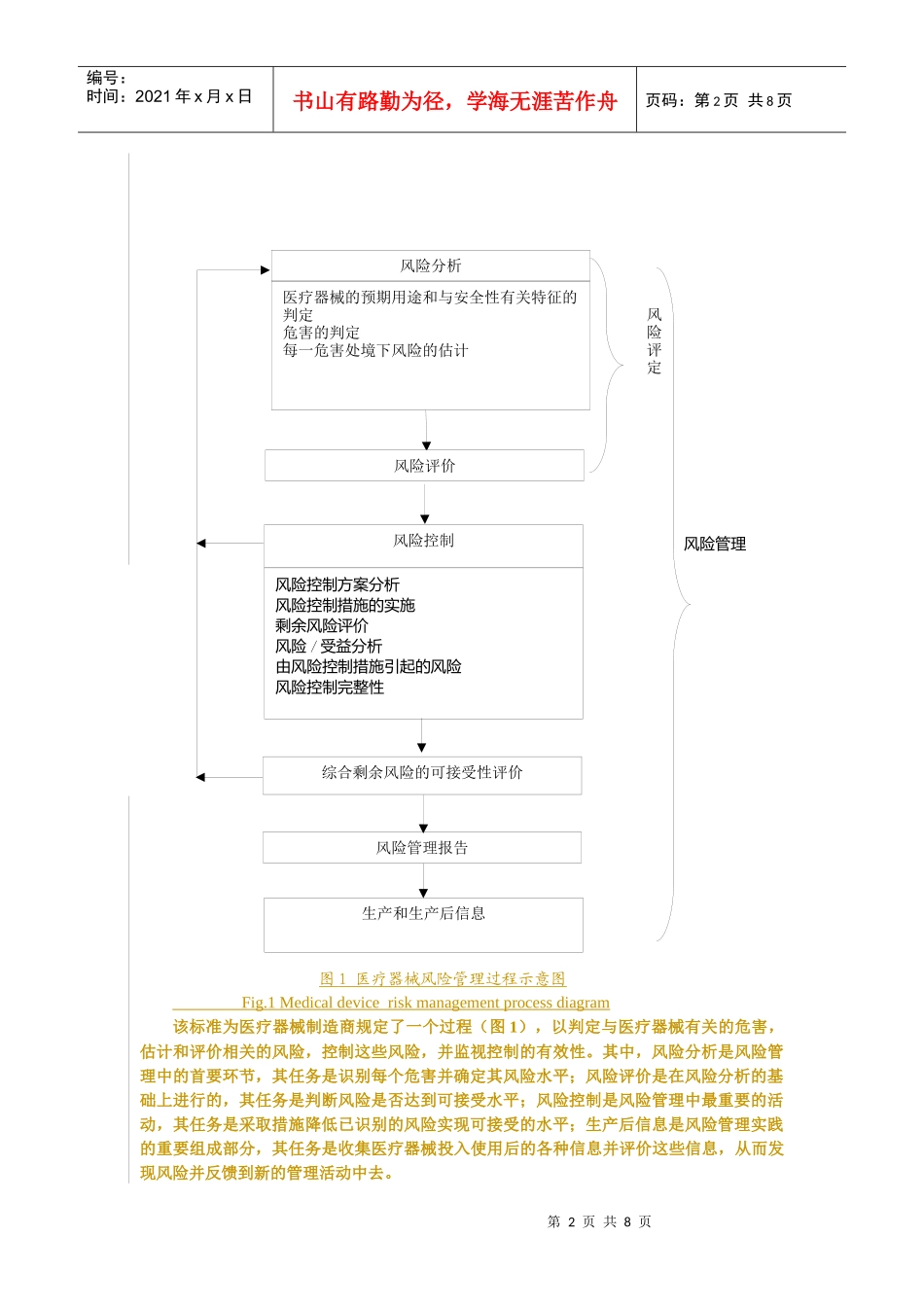
第1页共8页编号:时间:2021年x月x日书山有路勤为径,学海无涯苦作舟页码:第1页共8页谈我国医疗器械风险管理的法规要求【作者】作者王兰明国家食品药品监督管理局医疗器械司,(北京100810)【摘要】摘要:在分析我国医疗器械风险管理标准和医疗器械监管法规中风险管理要求的基础上,对在医疗器械监督管理中进一步推进实施风险管理进行了讨论。【关键词】关键词:医疗器械;监管法规;风险管理DiscussionsontheRegulatoryRequirementsforMedicalDeviceRiskManagementinChina【Writer】WANGLan-ming(DepartmentofMedicalDevices,StateFoodandDrugAdministration,,Beijing100810)【Abstract】Abstract:TherequirementsforriskmanagementincurrentmedicaldeviceregulationsinChinawerereviewed,andsomesuggestionsforthefutureweregiven.【Keywords】Keywords:MedicalDevice,;AdministrativeRegulation,;RiskManagement医疗器械作为用于预防、诊断、治疗人体疾病的特殊产品,普遍存在着可能造成不同程度的人体伤害的风险,这种风险存在于医疗器械设计开发、生产、流通、使用等各个环节。一种医疗器械被批准上市,只是表明基于现有认识水平其风险小大于获益,即其风险处于可接受的水平。风险管理是使产品的风险—获益平衡达到最优化的过程,是保障产品安全、有效的重要措施。本文在对我国现有医疗器械风险管理标准和医疗器械监管法规中的风险管理要求进行分析的基础上,对在医疗器械监督管理中进一步推进实施风险管理进行初步讨论。1.医疗器械风险管理的基本要求风险管理最早起源于航空工业,医疗器械也是较早开展风险管理活动的工业产品门类之一。世界上最早对医疗器械提出风险管理应用要求的标准是EN1441:1997,国际标准化组织ISO/TC210工作组和国际电工委员会IEC/SC62A工作组联合将该标准进行更新,发布了ISO14971-1:1998标准,在2000年后又进行了修订,相继发布了2000版、2007版,成为国际医疗器械风险管理活动的公认准则。我国在2000年等同转化ISO14971-1:1998,发布了YY/T0316-2000《医疗器械—风险管理:第一部分—风险分析对医疗器械的应用》。2003年等同转化ISO14971:2000,发布了YY/T0316-2003《医疗器械—风险管理对医疗器械的应用》。2008年4月,国家食品药品监督管理局发布了YY/T0316-2008《医疗器械—风险管理对医疗器械的应用》,该标准等同转化自ISO14971:2007,代替YY/T0316-2003,自2009年6月1日起实施[1]。第2页共8页第1页共8页风险评定风险管理生产和生产后信息风险分析医疗器械的预期用途和与安全性有关特征的判定危害的判定每一危害处境下风险的估计风险评价综合剩余风险的可接受性评价风险控制风险控制方案分析风险控制措施的实施剩余风险评价风险/受益分析由风险控制措施引起的风险风险控制完整性风险管理报告编号:时间:2021年x月x日书山有路勤为径,学海无涯苦作舟页码:第2页共8页图1医疗器械风险管理过程示意图Fig.1Medicaldeviceriskmanagementprocessdiagram该标准为医疗器械制造商规定了一个过程(图1),以判定与医疗器械有关的危害,估计和评价相关的风险,控制这些风险,并监视控制的有效性。其中,风险分析是风险管理中的首要环节,其任务是识别每个危害并确定其风险水平;风险评价是在风险分析的基础上进行的,其任务是判断风险是否达到可接受水平;风险控制是风险管理中最重要的活动,其任务是采取措施降低已识别的风险实现可接受的水平;生产后信息是风险管理实践的重要组成部分,其任务是收集医疗器械投入使用后的各种信息并评价这些信息,从而发现风险并反馈到新的管理活动中去。第3页共8页第2页共8页编号:时间:2021年x月x日书山有路勤为径,学海无涯苦作舟页码:第3页共8页为确保医疗器械安全特性的基本要求,本标准要求医疗器械制造商在产品实现的全过程中实施风险管理并形成文件,针对风险管理所进行的活动应保持记录。在医疗器械生命周期的不同阶段,有关风险管理示意图中每个要素的侧重点可能是不同的。同时,在标准中规定,该标准不规定可接受的风险水平,不用于临床决策,不要求制造商必须建立适当的质量体系。标准中强调,标准仅...