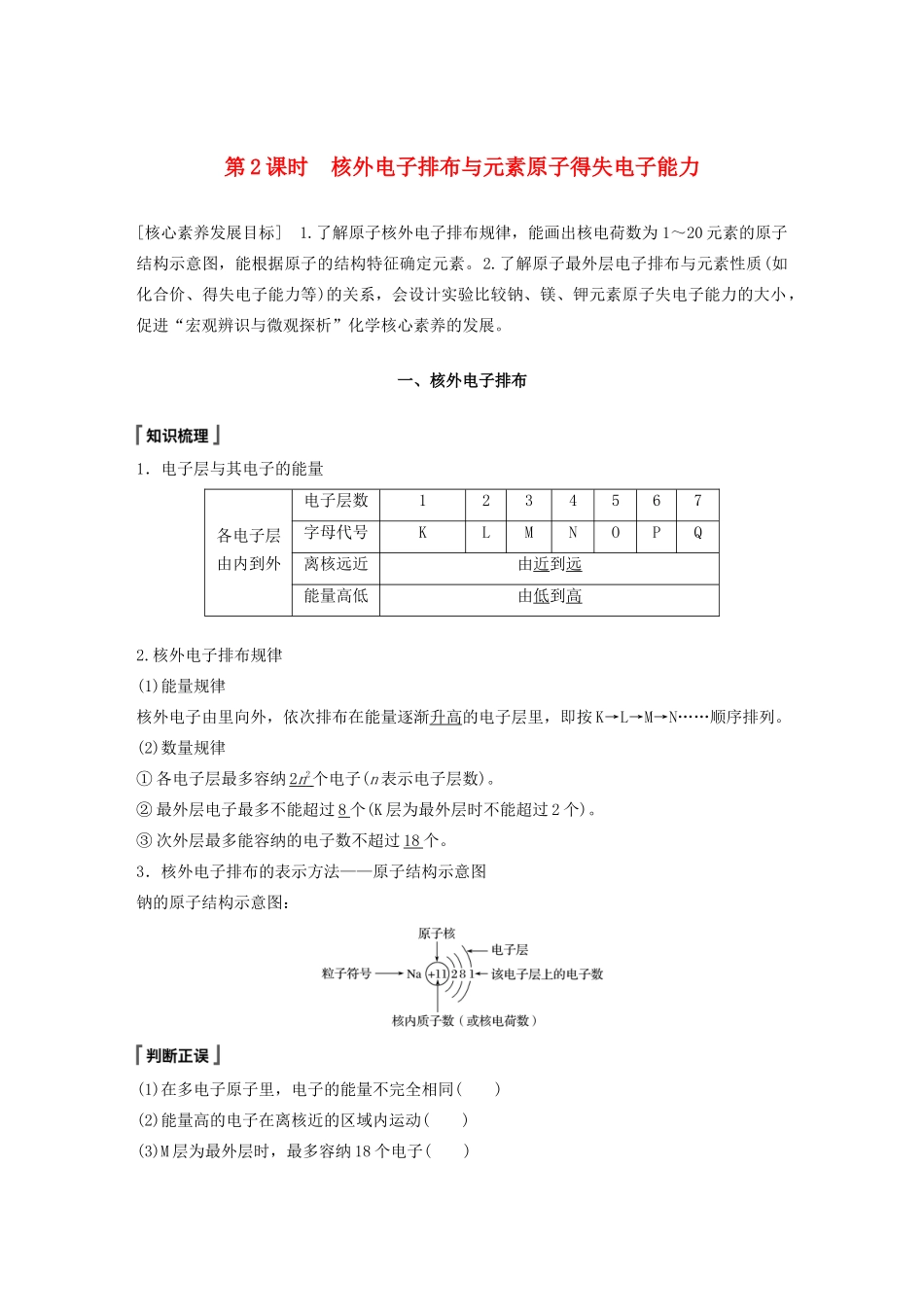
第2课时核外电子排布与元素原子得失电子能力[核心素养发展目标]1.了解原子核外电子排布规律,能画出核电荷数为1~20元素的原子结构示意图,能根据原子的结构特征确定元素。2.了解原子最外层电子排布与元素性质(如化合价、得失电子能力等)的关系,会设计实验比较钠、镁、钾元素原子失电子能力的大小,促进“宏观辨识与微观探析”化学核心素养的发展。一、核外电子排布1.电子层与其电子的能量各电子层由内到外电子层数1234567字母代号KLMNOPQ离核远近由近到远能量高低由低到高2.核外电子排布规律(1)能量规律核外电子由里向外,依次排布在能量逐渐升高的电子层里,即按K→L→M→N……顺序排列。(2)数量规律①各电子层最多容纳2n2个电子(n表示电子层数)。②最外层电子最多不能超过8个(K层为最外层时不能超过2个)。③次外层最多能容纳的电子数不超过18个。3.核外电子排布的表示方法——原子结构示意图钠的原子结构示意图:(1)在多电子原子里,电子的能量不完全相同()(2)能量高的电子在离核近的区域内运动()(3)M层为最外层时,最多容纳18个电子()(4)原子的次外层电子数都是8()(5)某原子L层上电子数一定为K层上电子数的4倍()答案(1)√(2)×(3)×(4)×(5)×1.根据下列微粒结构示意图,写出对应微粒符号。__________________;_________________________________________;__________________;_____________________________________。答案O2-Na+AlCl2.根据下列叙述,写出元素名称并画出原子结构示意图。(1)A元素原子的质量数为35、中子数为18:________________。(2)B元素原子核外M层电子数是L层电子数的一半:________________。(3)C元素原子的最外层电子数是次外层电子数的1.5倍:________________。答案(1)氯,(2)硅,(3)硼,核电荷数为1~20元素的原子结构特点(1)最外层电子数为1的原子有H、Li、Na、K;最外层电子数为2的原子有He、Be、Mg、Ca。(2)最外层电子数与次外层电子数相等的原子有Be、Ar;最外层电子数是次外层电子数2倍、3倍、4倍的原子分别是C、O、Ne。(3)次外层电子数是最外层电子数2倍的原子有Li、Si。(4)内层电子总数是最外层电子数2倍的原子有Li、P。(5)电子层数与最外层电子数相等的原子有H、Be、Al;电子层数是最外层电子数2倍的原子是Li、Ca。(6)最外层电子数是电子层数2倍的原子有He、C、S;最外层电子数是电子层数3倍的原子是O。1.下列化学符号表示同一种元素的是()①X②X③④A.只有①③B.①②③C.只有②③D.全部答案B2.某元素原子的原子核外有三个电子层,最外层电子数是4。该原子核内的质子数是()A.14B.15C.16D.17答案A3.某元素原子的最外层电子数是次外层的m倍(m为大于1的整数),则该原子的核外电子总数为()A.2mB.2m+10C.2m+2D.m+2答案C解析按照原子核外电子排布的一般规律,最外层电子数不超过8。最外层电子数是次外层的m倍(m为大于1的整数),所以次外层电子数小于8,即次外层只能为K层,电子数为2,最外层电子数是2m,则该原子的核外电子总数为2m+2,C正确。二、原子结构与元素原子得失电子能力(一)元素的性质与原子结构的关系元素种类稀有气体元素金属元素非金属元素最外层电子数8(He为2)(稳定结构)一般小于4一般大于或等于4原子得失电子能力既不易得电子也不易失电子易失电子易得电子单质性质难与其他物质反应具有还原性具有氧化性化合价0价只显正价一般为负价(二)实验验证方法1.金属性、非金属性通常指元素原子得失电子能力。2.比较活泼金属失电子能力的实验方法:元素的单质与水(或酸)反应置换出氢气的难易程度。(三)案例分析1.钠、镁元素原子失电子能力比较(1)分析预测钠原子与镁原子的电子层数相同,钠原子的核电荷数比镁小,钠原子最外层电子离核比镁远,更容易失去最外层电子,钠元素的金属性比镁强,单质钠与水(或酸)反应比镁更剧烈。(2)实验探究①通过实验甲说明钠与冷水剧烈反应,反应的化学方程式为2Na+2H2O===2NaOH+H2↑。②实验乙中,加热前,镁条表面附着了少量无色气泡,加热至沸腾后,有较多的无色气泡冒出,滴加酚酞溶液变为粉红色。该实验说明镁与冷水很难反应,能与热水反应,反应的化学方程式为Mg+2H2O=...