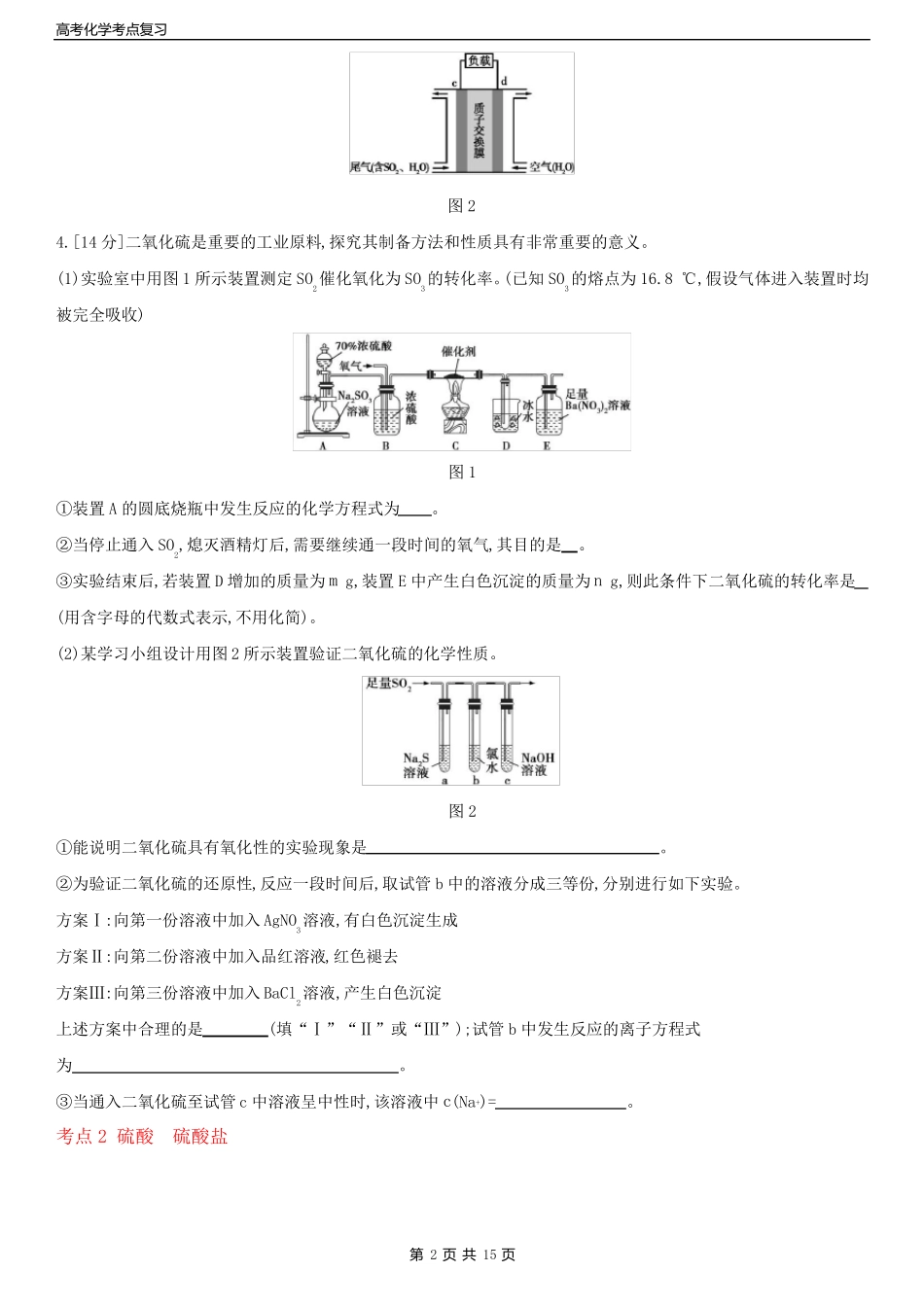
高考化学考点复习专题九氧、硫及其化合物和环境保护考点1硫及其氧化物硫的氢化物1.[2021江苏南京六校联考]下列制取SO2、验证其性质的装置(尾气处理装置已省略)和原理不能达到实验目的的是()2.[2021广东佛山南海区摸底测试]天然气是应用广泛的燃料,但含有少量H2S等气体。在酸性溶液中利用氧化亚铁硫杆菌可实现天然气的催化脱硫,其原理如图所示。下列说法不正确的是A.过程甲中发生反应的离子方程式为2Fe+H2SB.脱硫过程中O2间接氧化H2SC.该脱硫过程需要不断添加Fe2(SO4)3溶液D.过程乙中发生反应的离子方程式为4Fe+O2+4H2++3+()2Fe+S↓+2H2++4Fe+2H2O3+3.[2020四川成都摸底测试,11分]二氧化硫在生产和生活中有着广泛的用途。(1)SO2可用来制备定影剂Na2S2O3,反应的化学方程式为Na2CO3+2Na2S+4SO23Na2S2O3+CO2。请用单线桥表示该反应中的电子转移情况,还原剂与氧化剂的物质的量之比为。(2)用足量NaOH溶液吸收尾气中的SO2,反应的离子方程式为;吸收后的浓溶液可用图1所示装置再生循环脱硫,并制得硫酸,电极a的电极反应为,乙是。图1(3)可设计二氧化硫-空气质子交换膜燃料电池处理尾气中的二氧化硫,原理如图2所示。其能量转化的主要形式是,c电极是极,移动的离子及方向是。第1页共15页高考化学考点复习图24.[14分]二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。(1)实验室中用图1所示装置测定SO2催化氧化为SO3的转化率。(已知SO3的熔点为16.8℃,假设气体进入装置时均被完全吸收)图1①装置A的圆底烧瓶中发生反应的化学方程式为。②当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是。③实验结束后,若装置D增加的质量为mg,装置E中产生白色沉淀的质量为ng,则此条件下二氧化硫的转化率是(用含字母的代数式表示,不用化简)。(2)某学习小组设计用图2所示装置验证二氧化硫的化学性质。图2①能说明二氧化硫具有氧化性的实验现象是。②为验证二氧化硫的还原性,反应一段时间后,取试管b中的溶液分成三等份,分别进行如下实验。方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀上述方案中合理的是(填“Ⅰ”“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为。③当通入二氧化硫至试管c中溶液呈中性时,该溶液中c(Na)=。+考点2硫酸硫酸盐第2页共15页高考化学考点复习5.[2021北京顺义区测试改编][双选]某同学设计了蔗糖与浓硫酸反应的改进装置,并对气体产物进行检验,实验装置如图所示。下列结论中正确的是()选现象项Ⅰ中注入浓硫酸后,可A观察到试管中白色固体变为黑色Ⅱ中观察到棉球a、b都B褪色CⅡ中无水硫酸铜变蓝Ⅲ中溶液颜色变浅(未D褪色),Ⅳ中澄清石灰水变浑浊6.[2020北京,19,12分]探究Na2SO3固体的热分解产物。资料:①4Na2SO3Na2S+3Na2SO4。说明有CO2产生说明反应产物中有H2O均体现了SO2的漂白性体现了浓硫酸的脱水性结论②Na2S能与S反应生成Na2Sx,Na2Sx与酸反应生成S和H2S。③BaS易溶于水。隔绝空气条件下,加热无水Na2SO3固体得到黄色固体A,过程中未检测到气体生成。黄色固体A加水得到浊液,放置得无色溶液B。(1)检验分解产物Na2S取少量溶液B,向其中滴加CuSO4溶液,产生黑色沉淀,证实有S。反应的离子方程式是。(2)检验分解产物Na2SO4取少量溶液B,滴加BaCl2溶液,产生白色沉淀,加入盐酸,沉淀增多(经检验该沉淀含S),同时产生有臭鸡蛋气味的气体(H2S),由于沉淀增多对检验造成干扰,另取少量溶液B,加入足量盐酸,离心沉降(固液分离)后,(填操作和现象),可证实分解产物中含有SO2−4。(3)探究(2)中S的来源第3页共15页2-高考化学考点复习来源1:固体A中有未分解的Na2SO3,在酸性条件下与Na2S反应生成S。来源2:溶液B中有Na2Sx,加酸反应生成S。针对来源1进行如下实验:①实验可证实来源1不成立。实验证据是。②不能用盐酸代替硫酸的原因是。③写出来源2产生S的反应的离子方程式:。(4)实验证明Na2SO3固体热分解有Na2S、Na2SO4和S产生。运用氧化还原反应规律分析产物中S产生的合理(5)性:。考点3臭氧和过氧化氢环境保护7.[2021北京通州区检测,14分]H2O2溶液在工业生产和日常生活中应用广泛。(1)H2O...