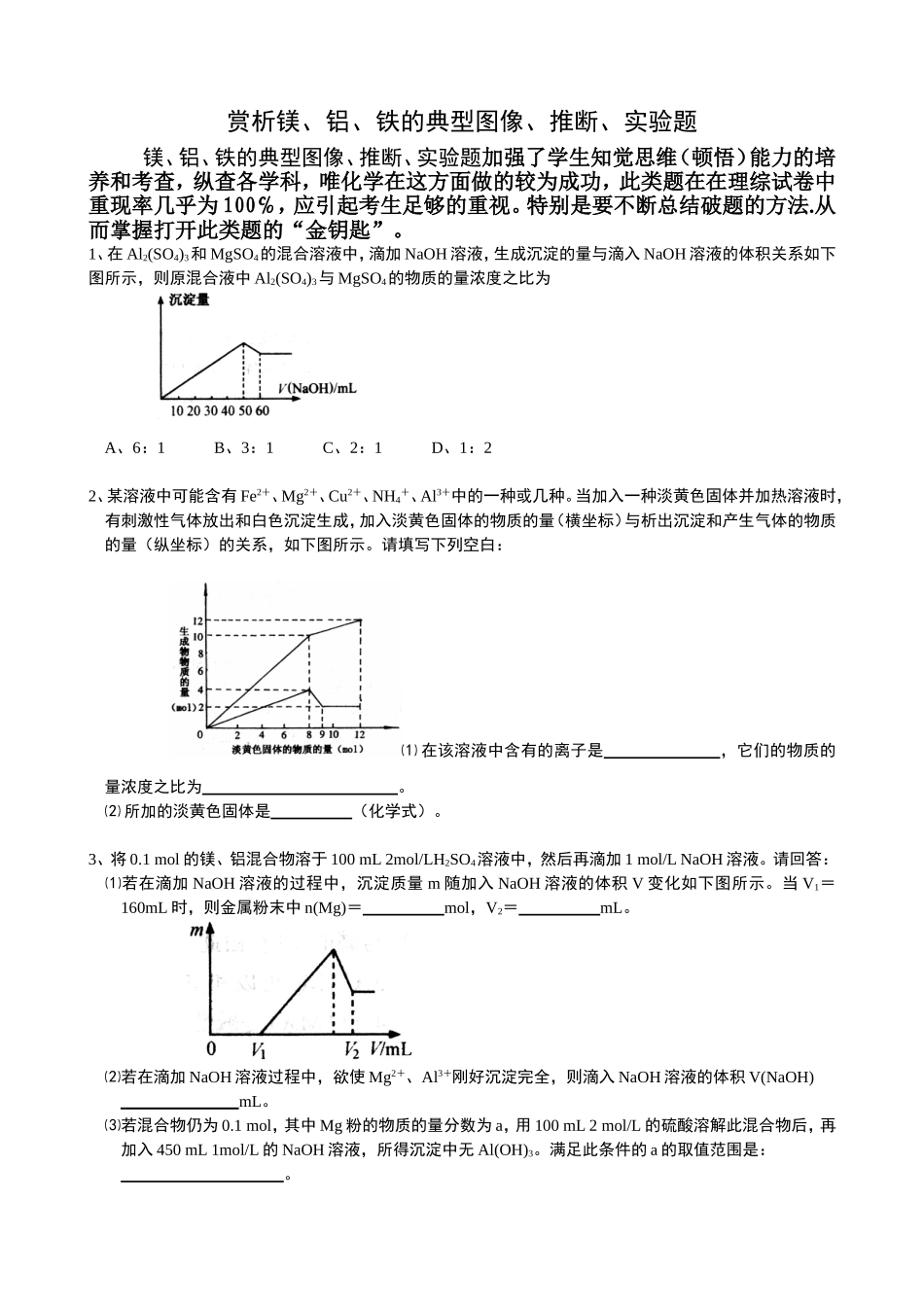
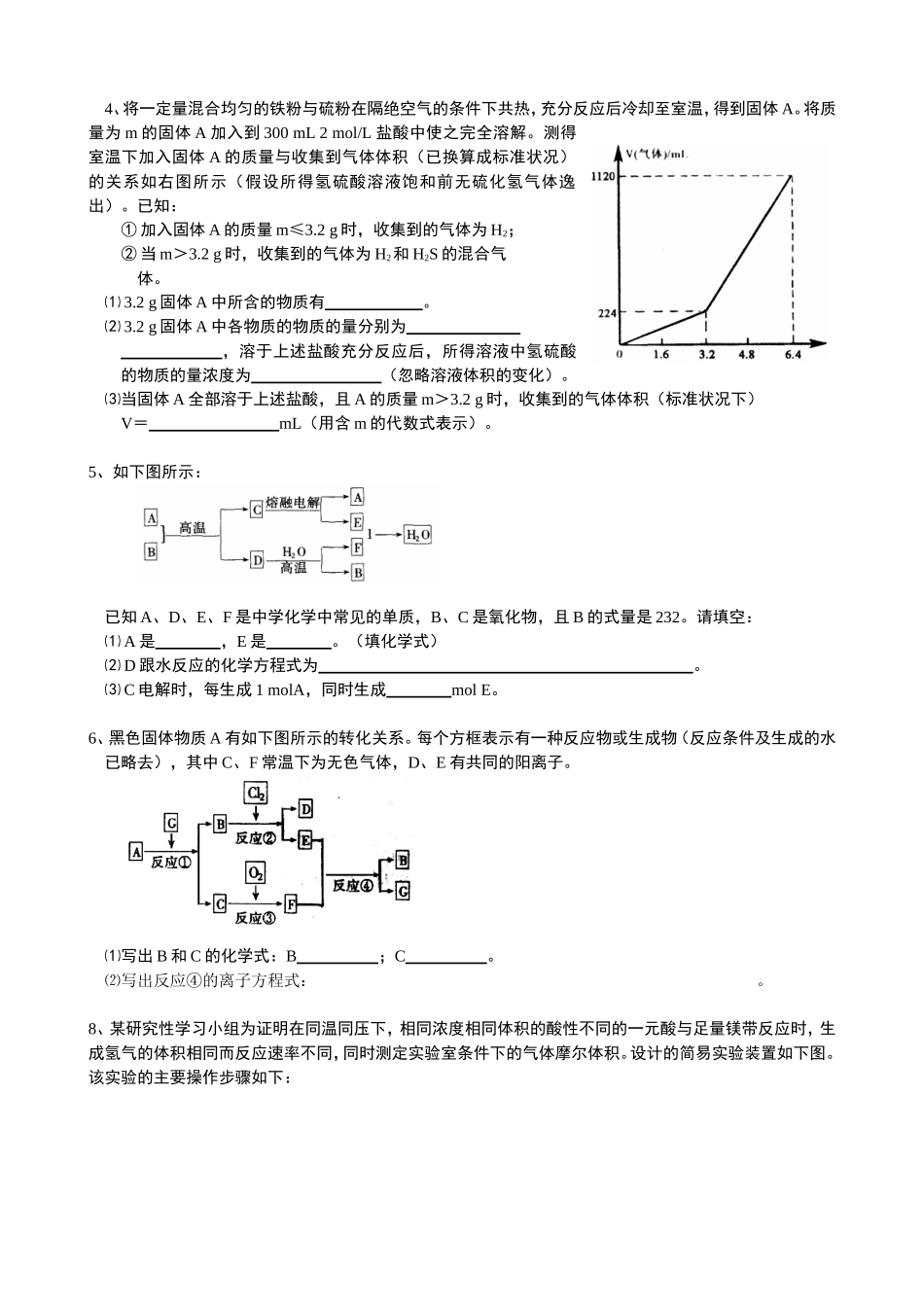
赏析镁、铝、铁的典型图像、推断、实验题镁、铝、铁的典型图像、推断、实验题加强了学生知觉思维(顿悟)能力的培养和考查,纵查各学科,唯化学在这方面做的较为成功,此类题在在理综试卷中重现率几乎为100℅,应引起考生足够的重视。特别是要不断总结破题的方法.从而掌握打开此类题的“金钥匙”。1、在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如下图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为A、6:1B、3:1C、2:1D、1:22、某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种。当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系,如下图所示。请填写下列空白:⑴在该溶液中含有的离子是,它们的物质的量浓度之比为。⑵所加的淡黄色固体是(化学式)。3、将0.1mol的镁、铝混合物溶于100mL2mol/LH2SO4溶液中,然后再滴加1mol/LNaOH溶液。请回答:⑴若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。当V1=160mL时,则金属粉末中n(Mg)=mol,V2=mL。⑵若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)mL。⑶若混合物仍为0.1mol,其中Mg粉的物质的量分数为a,用100mL2mol/L的硫酸溶解此混合物后,再加入450mL1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是:。4、将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A。将质量为m的固体A加入到300mL2mol/L盐酸中使之完全溶解。测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如右图所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出)。已知:①加入固体A的质量m≤3.2g时,收集到的气体为H2;②当m>3.2g时,收集到的气体为H2和H2S的混合气体。⑴3.2g固体A中所含的物质有。⑵3.2g固体A中各物质的物质的量分别为,溶于上述盐酸充分反应后,所得溶液中氢硫酸的物质的量浓度为(忽略溶液体积的变化)。⑶当固体A全部溶于上述盐酸,且A的质量m>3.2g时,收集到的气体体积(标准状况下)V=mL(用含m的代数式表示)。5、如下图所示:已知A、D、E、F是中学化学中常见的单质,B、C是氧化物,且B的式量是232。请填空:⑴A是,E是。(填化学式)⑵D跟水反应的化学方程式为。⑶C电解时,每生成1molA,同时生成molE。6、黑色固体物质A有如下图所示的转化关系。每个方框表示有一种反应物或生成物(反应条件及生成的水已略去),其中C、F常温下为无色气体,D、E有共同的阳离子。⑴写出B和C的化学式:B;C。⑵写出反应④的离子方程式:。8、某研究性学习小组为证明在同温同压下,相同浓度相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如下图。该实验的主要操作步骤如下:①配制浓度均为1mol/L盐酸和醋酸溶液;②用量取10.00mL1mol/L盐酸和醋酸溶液分别加入两个锥形瓶中;③分别称取除去表面氧化膜的镁带ag,并系于铜丝末端,a的数值至少为;④在广口瓶中装足量的水,按图连接好装置;检查装置的气密性;⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录;⑥反应结束后,待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应,读出量筒中水的体积为VmL。请将上述步骤补充完整并回答下列问题:⑴用文字表述④检查该装置气密性的操作与观察方法:。⑵本实验中应选用(填序号)的量筒。A、100mLB、200mLC、500mL⑶若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为:Vm=。⑷简述速率不等的原因,铜丝不与酸接触的原是。9、在标准状况下进行甲、乙、丙三组实验:三组各取30.0mL同浓度的盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:实验序号甲乙丙合金质量/mg255385459产生气体体积/mL280336336请回答:⑴甲组实验中,盐酸(选填“适量”“过量”...