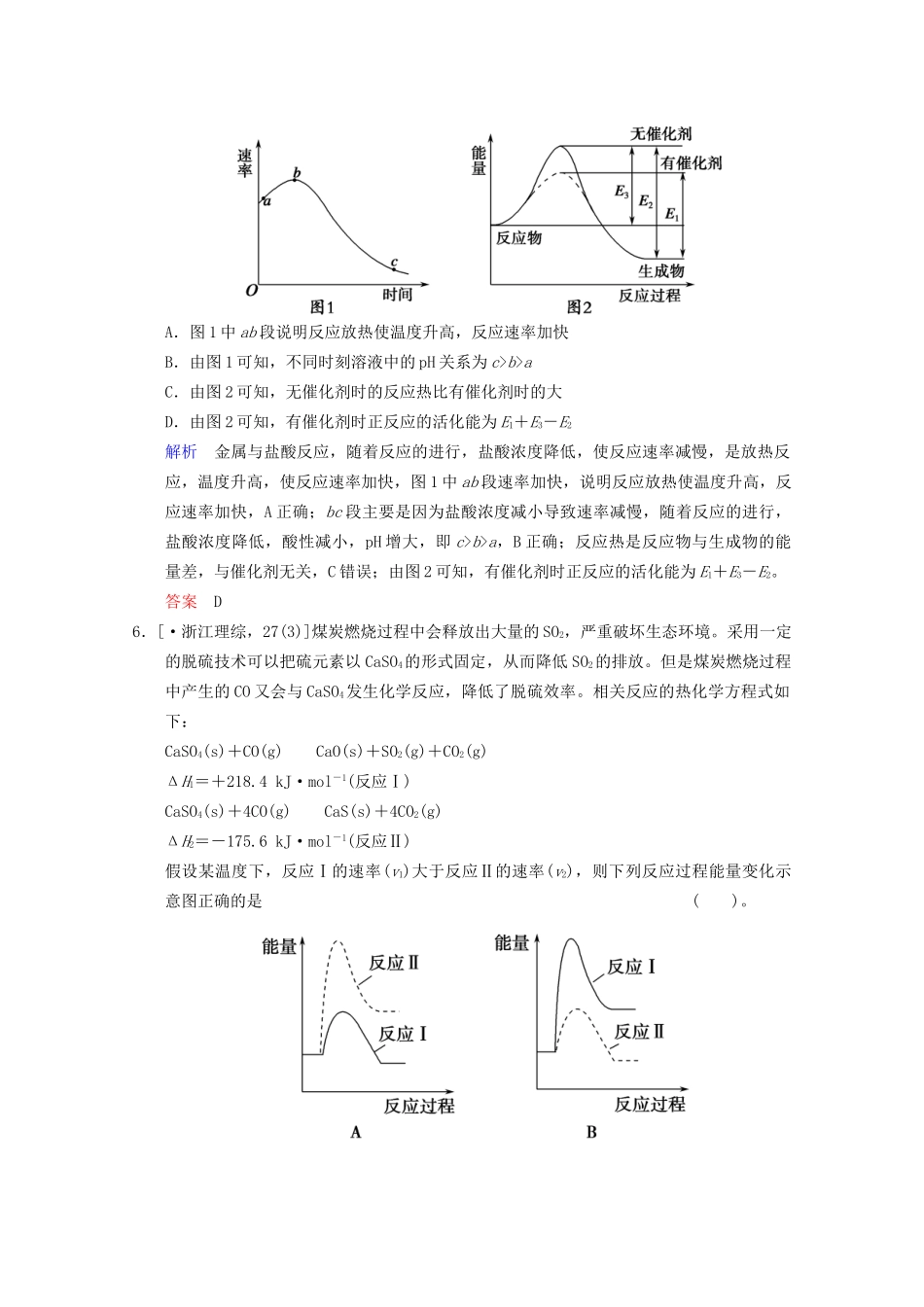
第5讲化学反应与能量一、小题对点练一、反应热和焓变的分析与判断1.(·上海,9改编)将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见()。A.NH4HCO3和盐酸的反应是放热反应B.该反应中,热能转化为产物内部的能量C.反应物的总能量高于生成物的总能量D.反应的热化学方程式为NH4HCO3+HCl===NH4Cl+CO2+H2OΔH=+QkJ·mol-1解析根据醋酸逐渐凝固说明NH4HCO3与盐酸的反应是吸热反应,则A、C错误,B正确;热化学方程式的书写要标出物质的状态,D错误。答案B2.(·深圳模拟)氯原子对O3的分解有催化作用:O3+Cl=====ClO+O2ΔH1,ClO+O=====Cl+O2ΔH2。大气臭氧层的分解反应是:O3+O=====2O2ΔH,该反应的能量变化如图所示,则下列叙述正确的是()。①反应O3+O=====2O2的ΔH=E1-E3②反应O3+O=====2O2是放热反应③ΔH=ΔH1+ΔH2④大气层中的臭氧无法再生A.①②B.②③C.③④D.②④解析由题图可知反应O3+O=====2O2为放热反应,ΔH=-(E2-E3);根据盖斯定律,由第一个热化学方程式+第二个热化学方程式可得O3+O=====2O2,则ΔH=ΔH1+ΔH2;闪电会使反应3O2=====2O3发生,即臭氧可再生。答案B3.(·盐城调研)下列叙述正确的是()。A.同温同压下,4Al(s)+3O2(g)=====2Al2O3(s)在常温和点燃条件下的ΔH不同B.在某反应中,当反应物具有的总能量大于生成物具有的总能量时,该反应放热,ΔH>0C.已知C(s)+O2(g)=====CO2(g)ΔH=-196.8kJ·mol-1,则碳的燃烧热是ΔH=-196.8kJ·mol-1D.已知NaOH(aq)+HCl(aq)=====NaCl(aq)+H2O(l)ΔH=-57.4kJ·mol-1,则含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的能量解析A项,反应热与反应条件无关;B项,反应放热时ΔH<0;C项,燃烧热所对应的可燃物的物质的量应为1mol;D项,20.0gNaOH的物质的量为0.5mol,发生中和反应放出的热量为0.5mol×57.4kJ·mol-1=28.7kJ。答案D4.(·苏锡常镇一调)下列关于反应过程中能量变化的说法,正确的是()。A.右图中a、b曲线可分别表示反应CH2===CH2(g)+H2(g)―→CH3CH3(g)ΔH<0,使用和未使用催化剂时,反应过程中的能量变化B.已知2C(s)+2O2(g)===2CO2(g)ΔH1,2C(s)+O2(g)===2CO(g)ΔH2,则ΔH1>ΔH2C.同温同压下,反应H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同D.在一定条件下,某可逆反应的ΔH=+100kJ·mol-1,则该反应正反应活化能比逆反应活化能大100kJ·mol-1解析反应物总能量低于生成物总能量,为吸热反应,ΔH>0,A错误;完全燃烧时释放的能量多,但是ΔH<0,则ΔH1<ΔH2,B错误;ΔH的值与反应条件无关,C错误;ΔH=+100kJ·mol-1,说明为吸热反应,如图:,Ea(正)为正反应活化能,Ea(逆)为逆反应活化能,D正确。答案D5.(·徐宿三模)将除去氧化膜的某金属片投入一定量的稀盐酸中,产生氢气的速率与时间的关系及反应过程中能量的变化分别如图1、图2所示。下列说法不正确的是()。A.图1中ab段说明反应放热使温度升高,反应速率加快B.由图1可知,不同时刻溶液中的pH关系为c>b>aC.由图2可知,无催化剂时的反应热比有催化剂时的大D.由图2可知,有催化剂时正反应的活化能为E1+E3-E2解析金属与盐酸反应,随着反应的进行,盐酸浓度降低,使反应速率减慢,是放热反应,温度升高,使反应速率加快,图1中ab段速率加快,说明反应放热使温度升高,反应速率加快,A正确;bc段主要是因为盐酸浓度减小导致速率减慢,随着反应的进行,盐酸浓度降低,酸性减小,pH增大,即c>b>a,B正确;反应热是反应物与生成物的能量差,与催化剂无关,C错误;由图2可知,有催化剂时正反应的活化能为E1+E3-E2。答案D6.[·浙江理综,27(3)]煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低了脱硫效率。相关反应的热化学方程式如下:CaSO4(s)+CO(g)CaO(s)+SO2(g)+CO2(g)ΔH1=+218.4kJ·mol-1(反应Ⅰ)CaSO4(s)+4CO(g)CaS(s)+4CO2(g)ΔH2=-175.6kJ·...