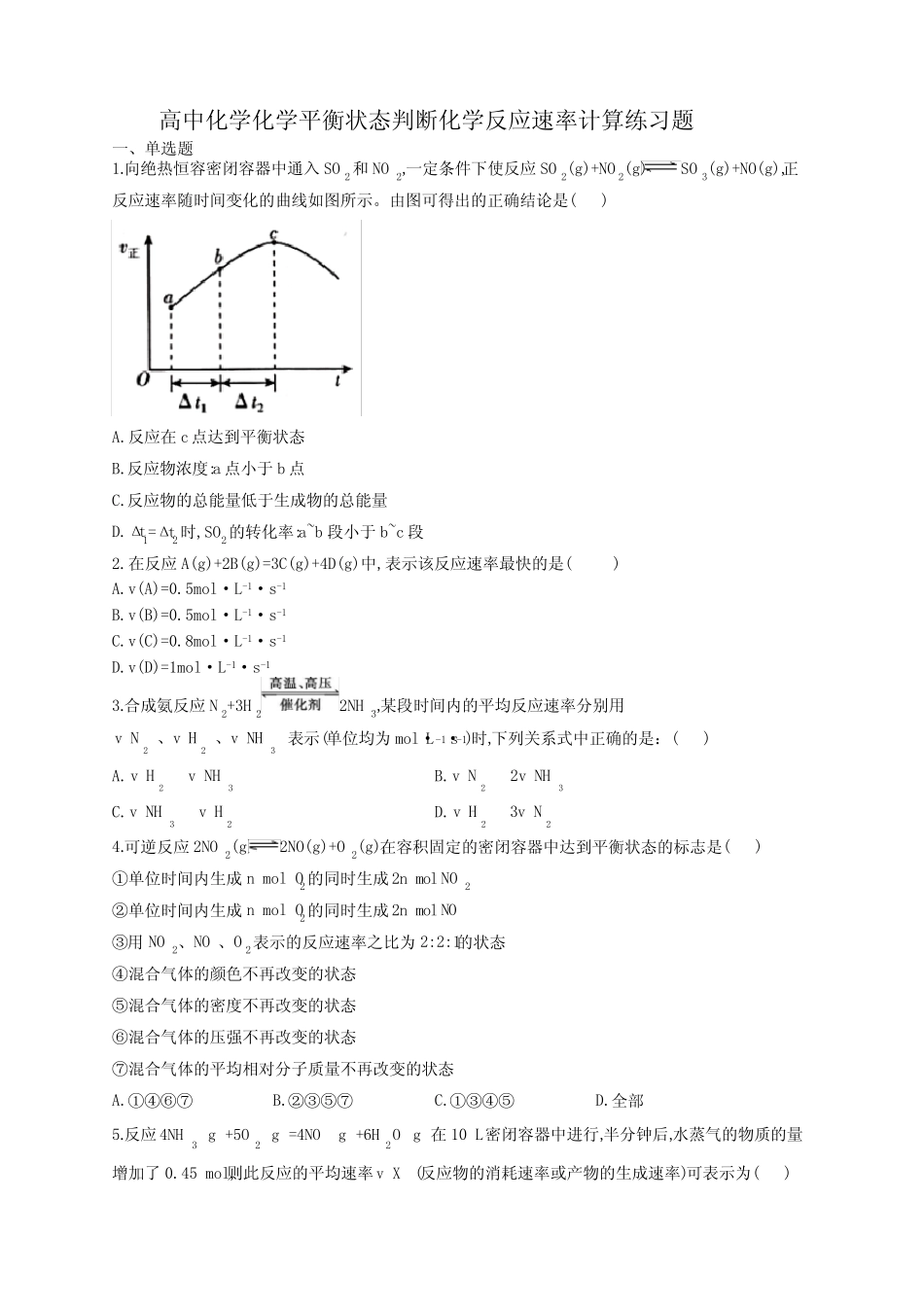
高中化学化学平衡状态判断化学反应速率计算练习题一、单选题1.向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g),正反应速率随时间变化的曲线如图所示。由图可得出的正确结论是()A.反应在c点达到平衡状态B.反应物浓度:a点小于b点C.反应物的总能量低于生成物的总能量D.Δt1=Δt2时,SO2的转化率:a~b段小于b~c段2.在反应A(g)+2B(g)=3C(g)+4D(g)中,表示该反应速率最快的是()A.v(A)=0.5mol·L-1·s-1B.v(B)=0.5mol·L-1·s-1C.v(C)=0.8mol·L-1·s-1D.v(D)=1mol·L-1·s-13.合成氨反应N2+3H22NH3,某段时间内的平均反应速率分别用223NHNHvvv、、表示(单位均为mol·L-1·s-1)时,下列关系式中正确的是:()A.23HNHvvB.23N2NHvvC.32NHHvvD.22H3Nvv4.可逆反应2NO2(g)2NO(g)+O2(g),在容积固定的密闭容器中达到平衡状态的标志是()①单位时间内生成nmolO2的同时生成2molnNO2②单位时间内生成nmolO2的同时生成2molnNO③用NO2、NO、O2表示的反应速率之比为2:2:1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态A.①④⑥⑦B.②③⑤⑦C.①③④⑤D.全部5.反应3224NHg+5Og=4NOg+6HOg在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率Xv(反应物的消耗速率或产物的生成速率)可表示为()A.3NH=0.010mol/LsvB.2O=0.0010mol/LsvC.NO=0.0010mol/LsvD.2HO=0.0045mol/Lsv6.—定温度下,在固定体积的密闭容器中发生下列反应:222HI=H+I。若HIc由0.1mol/L降到0.07mol/L时需要15s时间,那么c(HI)由0.07mol/L降到0.05mol/L时,所需反应的时间()A.等于5sB.等于10sC.大于10sD.小于10s7.为了说明影响化学反应进行快慢的因素,甲、乙、丙、丁四位同学分别设计了如下A~D四个实验,你认为结论不正确的是()A.将大小相同、形状相同的镁条和铝条与相同浓度的盐酸反应时,两者速率一样大B.在相同条件下,等质量的大理石块和大理石粉与相同浓度的盐酸反应时,大理石粉反应快C.将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解D.两支试管中分别加入相同质量的氯酸钾,向其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同8.下列有关化学反应速率的说法正确的是()A.用铁片和稀硫酸反应制取氢气时,改用9.8%的浓硫酸可以加快产生氢气的速率B.10.0mL2-1molL的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变C.2SO的催化氧化是一个放热的反应,所以升高温度,反应速率减慢D.汽车尾气中的NO和CO可以缓慢反应生成2N和2CO,减小压强,反应速率减慢9.对于可逆反应4NH3(g)+5O2(g)4NO(g)+6H2O(g),下列叙述正确的是()A.达到化学平衡时,4v正(O2)=5v逆(NO)B.若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达到平衡状态C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大D.化学反应速率关系是2v正(NH3)=3v正(H2O)10.一定温度下,在容积恒定的密闭容器中发生可逆反应Ag+3Bg2Cg,下列叙述一定是达到平衡的标志的是()①2vB=3vC正逆②单位时间内生成amolA,同时消耗2amolC③A、B、C的浓度不再变化④混合气体的总压强不再变化⑤C的质量分数不再改变⑥用A、B、C的物质的量浓度变化表示的反应速率之比为1:3:2的状态⑦A、B、C的浓度彼此相等⑧混合气体的密度不再改变的状态A.①③④⑤B.①④⑤⑦C.④⑤⑥⑧D.③⑤⑥⑦11.其他条件不变时,能使反应速率加快的是()A.对于反应Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,增大体系的压强B.对于反应N2(g)+3H2(g)2NH3(g),容器体积固定不变时,充入N2C.对于反应N2(g)+3H2(g)2NH3(g),容器体积固定不变时,充入ArD.对于反应N2(g)+3H2(g)2NH3(g),容器气体压强不变时,充入Ar12.一定温度下,反应N2O4(g)2NO2(g)的焓变为ΔH。现将1molN2O4充入一恒压密闭容器中,下列示意图能说明反应达到平衡状态的是()A.①②B.②④C.③④D.①④13.在一密闭容器中进行反应:催化剂2SO2(g)+O2(g)2SO3(g)...