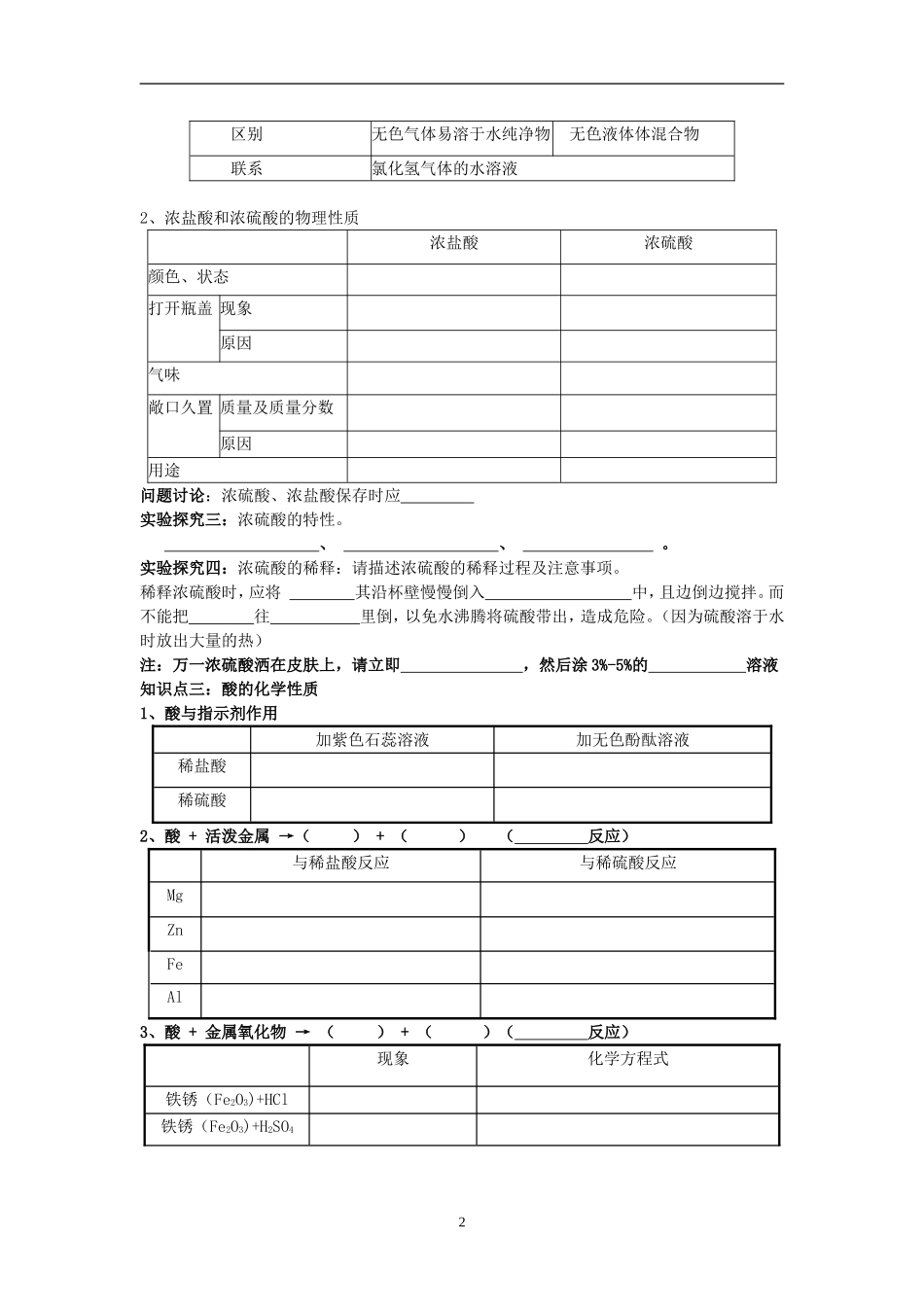
1《常见的酸和碱》一、课前先学酸(写出下列酸的化学式):硫酸、盐酸、碳酸、从化学式的组成看,酸由和组成。碱(写出下列碱的化学式):氢氧化钠氢氧化钙氢氧化铜氨水从化学式组成看,碱由和组成。盐(写出下列盐的化学式):氯化钠氯化钡碳酸钠碳酸氢钠碳酸钙氯化铵,从化学式的组成看,盐是由和组成1.能跟或起作用而显示不同的颜色的物质。常见的指示剂有和。2.浓硫酸具有强烈的性,在稀释浓硫酸时,一定要把倒入中3.酸能够与、、、等类型物质反应4.氢氧化钠俗名、、,它具有强烈的性,能吸水而,在生活中用作。5.生石灰与水反应的化学方程式,氢氧化钙俗名、。6.碱能与、、、等类型物质反应7.酸具有相似的化学性质是因为酸在水溶液中都含有;碱具有相似的化学性质是因为碱在水溶液中都含有。8、金属活动顺序表()二、课堂互动知识点一:酸碱指示剂将实验现象填入表格中,并得出实验结论。紫色石蕊试液无色酚酞试液酸(酸性)溶液碱(碱性)溶液跟踪练习:1.盐酸是酸溶液,它使紫色石蕊溶液变______,遇无色酚酞溶液_______。2.氢氧化钠溶液是碱溶液,它使石蕊溶液变____,使酚酞溶液变______。3.下表是四种花的提取液实验的(酒精用于提取花中的色素)酒精中酸溶液中碱溶液中大红花粉红色橙色绿色紫罗兰紫色红色蓝色万寿菊黄色黄色黄色⑴上表中能做酸碱指示剂的花汁是;____________⑵将厨房中的少量白醋滴入大红花的花汁中,可以看到的现象是_________;⑶若将紫罗兰提取液滴入氯化钠溶液中,则可看到的现象是____________。知识点二:浓盐酸、浓硫酸的物理性质、特性及用途:实验探究二:分别观察浓盐酸、浓硫酸的状态并打开瓶盖观察现象,并完成下表。1、盐酸——氯化氢气体的水溶液氯化氢盐酸2区别无色气体易溶于水纯净物无色液体体混合物联系氯化氢气体的水溶液2、浓盐酸和浓硫酸的物理性质浓盐酸浓硫酸颜色、状态打开瓶盖现象原因气味敞口久置质量及质量分数原因用途问题讨论:浓硫酸、浓盐酸保存时应实验探究三:浓硫酸的特性。、、。实验探究四:浓硫酸的稀释:请描述浓硫酸的稀释过程及注意事项。稀释浓硫酸时,应将其沿杯壁慢慢倒入中,且边倒边搅拌。而不能把往里倒,以免水沸腾将硫酸带出,造成危险。(因为硫酸溶于水时放出大量的热)注:万一浓硫酸洒在皮肤上,请立即,然后涂3%-5%的溶液知识点三:酸的化学性质1、酸与指示剂作用加紫色石蕊溶液加无色酚酞溶液稀盐酸稀硫酸2、酸+活泼金属→()+()(反应)与稀盐酸反应与稀硫酸反应MgZnFeAl3、酸+金属氧化物→()+()(反应)现象化学方程式铁锈(Fe2O3)+HCl铁锈(Fe2O3)+H2SO43CuO+HClCuO+H2SO4备注:当溶液中含有Fe3+时,溶液显色;当溶液中含有Fe2+时,溶液显色;当溶液中含有Cu2+时,溶液显色;4、酸+盐→()+()(反应)CaCO3+HCl=HCl+AgNO3=H2SO4+BaCl2=知识点四:比较氢氧化钠与氢氧化钙的性质氢氧化钠氢氧化钙俗名物理性质颜色状态溶解性腐蚀性特性制备用途用途注:如果不慎将碱液沾到皮肤上,要用,再涂上溶液。跟踪练习:请仔细阅读,回答下列问题:(1)这包干燥剂吸收水分的反应方程式是。(2)“请勿食用”是因为干燥剂吸水后具有九、碱的化学性质知识点五:1、碱与指示剂反应:紫色石蕊溶液无色酚酞溶液氢氧化钠溶液氢氧化钙溶液2、碱+非金属氧化物→()+()()CO2+Ca(OH)2=CO2+NaOH=SO2+NaOH=SO3+NaOH=食品公司通常在“**雪饼”的包装袋内放入一小包干燥剂,上面的部分文字如下:干燥剂DESICCANT请勿食用DONOTEAT请注意:(1)本干燥剂主要成分为生石灰(2)请勿食用(3)万一误入眼睛,请先用水清洗后,求诊于医师、(4)请慎防取玩4思考:氢氧化钠为什么要密封保存?如何检验氢氧化钠是否变质?3、碱+盐→()+()(反应)NaOH+CuSO4=NaOH+FeCl3=Ca(OH)2+Na2CO3=跟踪练习:1.碱溶液有相似的化学性质的原因是碱溶液中都含有()A.氢离子B.氢氧根离子C.金属离子D.酸根离子2.鉴别石灰水和氢氧化钠溶液可选用的试剂是()A、酚酞溶液B、稀盐酸C、CuOD、二氧化碳3.下列物质中常用来改良土壤酸性的是()A.石灰石B.熟石灰C.干冰D.烧碱4.纯净的氢氧化钠是一种_______色固体,由于在空...