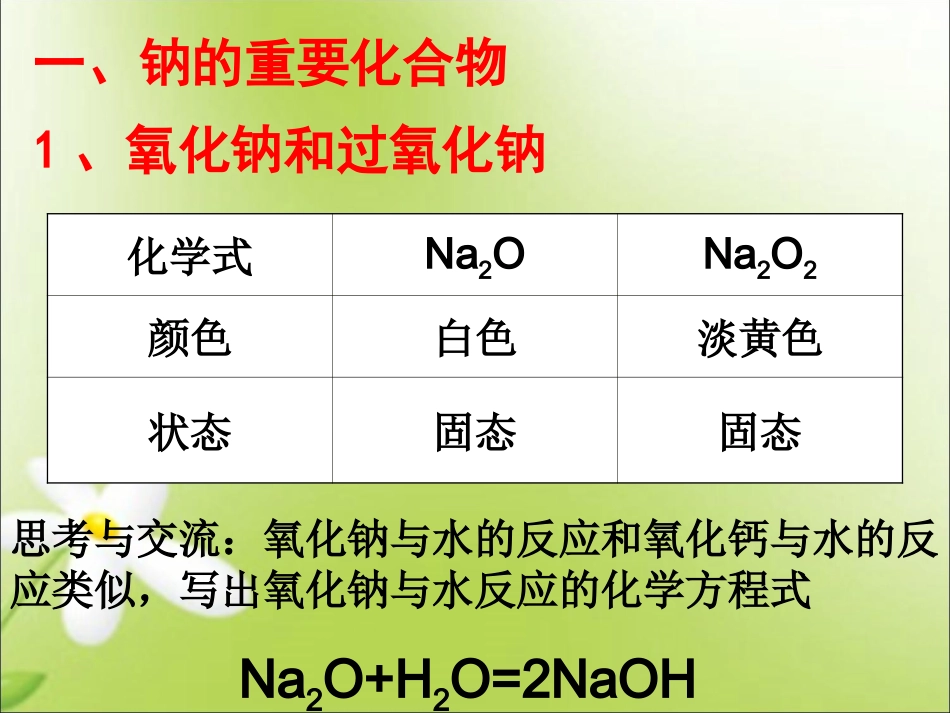
第二节几种重要的金属化合物第三章金属及其化合物一、钠的重要化合物1、氧化钠和过氧化钠化学式Na2ONa2O2颜色白色淡黄色状态固态固态思考与交流:氧化钠与水的反应和氧化钙与水的反应类似,写出氧化钠与水反应的化学方程式Na2O+H2O=2NaOHNa2O+CO2=Na2CO3问:Na2O2是否能表现类似的性质?(1)过氧化钠与水反应实验3-5过氧化钠与水反应现象:产生大量气泡;带火星的木条复燃;试管外壁发热;滴加酚酞溶液变红2Na2O2+2H2O=4NaOH+O2↑(2)过氧化钠与二氧化碳反应实验:过氧化钠与二氧化碳反应2Na2O2+2CO2==2Na2CO3+O2Na2O2既是氧化剂又是还原剂。两者都是放热反应,放出热能使棉花燃烧,生成的氧气更使棉花燃烧加剧。Na2O和Na2O2的性质比较名称氧化钠过氧化钠化学式色态与H2O反应与CO2反应O化合价生成条件特性及用途Na2ONa2O2白色固体淡黄色固体Na2O+H2O==2NaOH2Na2O2+2H2O==4NaOH+O2↑Na2O+CO2==Na2CO32Na2O2+2CO2==2Na2CO3+O2碱性氧化物过氧化物常温加热或点燃供氧剂、强氧化剂、漂白剂-2价-1价2、碳酸钠和碳酸氢钠科学探究:碳酸钠和碳酸氢钠的性质探究(1)步骤Na2CO3NaHCO3①②③初步结论白色粉末,加水结块变成晶体;放热细小白色晶体,加水部分溶解;感受不到热量变化振荡时间长时可溶解还有少量固体未溶解溶液变为淡红色溶液变红(较深)Na2CO3溶解放热,溶解度较大,碱性较强加水部分溶解,溶解度比Na2CO3小碱性比Na2CO3弱探究(2)热稳定性现象化学方程式结论Na2CO3NaHCO3探究(3)与酸反应CO32-+H+=HCO3-HCO3-+H+=H2O+CO2↑石灰水不变浑浊有气泡冒出石灰水变浑浊稳定不稳定,受热分解Na2CO3和NaHCO3性质比较物质碳酸钠碳酸氢钠化学式Na2CO3NaHCO3俗名色态溶解性与H+反应与可溶性钡、钙盐热稳定性用途△纯碱、苏打小苏打白色粉末白色晶体易溶于水溶解度相对较小慢,CO32―+2H+==H2O+CO2↑快,HCO3―+H+==H2O+CO2↑Ba2++CO32―=BaCO3↓Ca2++CO32―=CaCO3↓不反应稳定,受热难分解,Na2CO3·10H2O易风化不稳定,2NaHCO3Na2CO3+H2O+CO2↑玻璃,制皂,造纸,纺织发酵粉,制药实验3-6:金属的焰色反应钠:黄色钾:紫色钙:砖红色铜:绿色3、焰色反应定义:很多金属或它们的化合物在灼烧时都会使火焰发出特殊的颜色,在化学上称为焰色反应。操作:洗――烧――蘸――烧――观二、铝的重要化合物1、氧化铝(1)物理性质(2)化学性质Al2O3+6H+=2Al3++3H2OAl2O3+2OH-=2AlO2+H2O白色粉末、难溶于水、熔点高(2050℃)既与酸反应又与强碱反应生成盐和水(两性氧化物)2、氢氧化铝讨论:如何制取氢氧化铝?方法——铝盐和碱反应氢氧化铝的实验室制法氨水与铝盐反应Al3++3NH3.H2O=Al(OH)3↓+3NH4+水蒸气的发生装置水蒸气与铁粉反应装置产物收集装置实验内容实验现象结论化学反应方程式离子反应方程式沉淀溶解沉淀溶解氢氧化铝与氢氧化钠反应而溶解氢氧化铝与盐酸反应而溶解Al(OH)3+NaOH=NaAlO2+2H2OAl(OH)3+OH¯=AlO2+2H2OAl(OH)3+3HCl=AlCl3+3H2OAl(OH)3+3H+=Al3++3H2O取一份氢氧化铝,向其中逐滴滴入氢氧化钠观察现象取一份氢氧化铝,向其中滴入盐酸观察现象。向氢氧化铝中滴加氨水沉淀不溶解氢氧化铝不与氨水反应1.氢氧化铝的物理性质2.化学性质Al(OH)3+OH¯=AlO2+2H2OAl(OH)3+3H+=Al3++3H2O白色、胶状、难溶的物质典型的两性氢氧化物的性质——与强酸、强碱反应AlO2Al(OH)3Al3+HClNaOHNaOH思考:氢氧化铝的用途胃不痛了,多亏了胃舒平!!!1、中和胃酸:胃舒平(复方氢氧化铝)HCl2、净水明矾:KAl(SO4)2·12H2O(1)物理性质:无色晶体、易溶于水(2)化学性质:在水中完全电离KAl(SO4)2=K++Al3++2SO42-Al3++3H2O(胶体)Al(OH)3+3H+一、铝的化合物之间的转化——“铝三角”拓展:有关Al(OH)3沉淀的图像及计算1、向1mol氯化铝中逐滴加入氢氧化钠,画出生成的n[Al(OH)3]与消耗的n(NaOH)的关系图拓展:有关Al(OH)3沉淀的图像及计算2、若向1molNaAlO2溶液中逐滴加入盐酸,情况又如何呢?活动一、认识铁的常见氧化物化学式FeOFe2O3Fe3O4颜色、状态俗称铁元素价态水溶性与盐酸反应的离子方程式主要用途黑色粉末黑色粉末黑色粉末黑色粉末红棕色粉末红棕色粉末红棕色粉末红棕色粉...