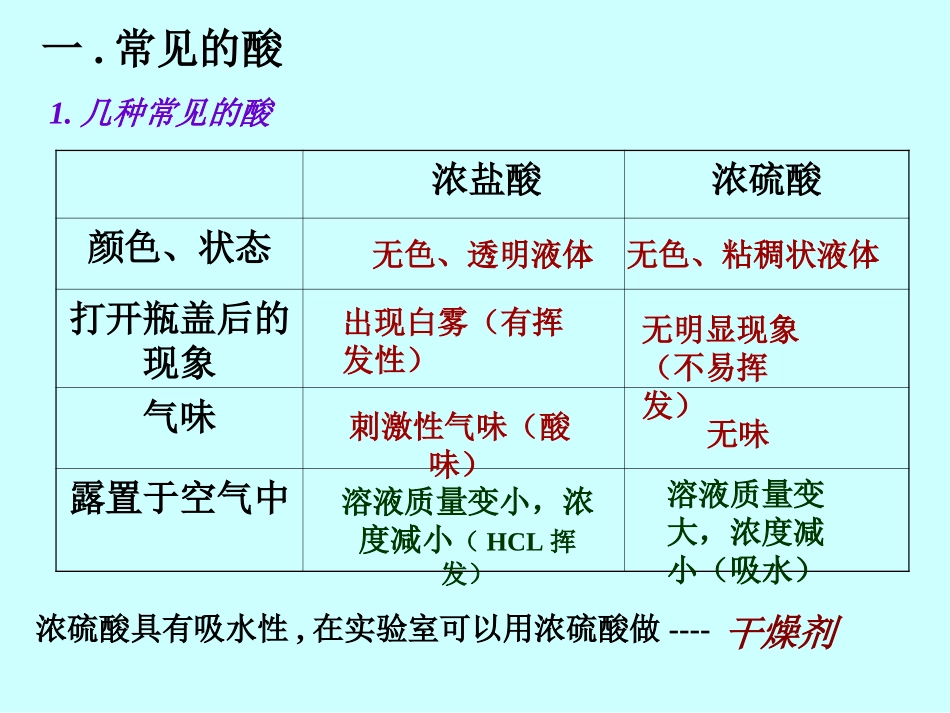
第十单元酸和碱课题1常见的酸和碱(第1、2课时)加入紫色石蕊溶液后的颜色变化加入无色酚酞溶液后的颜色变化食醋石灰水盐酸氢氧化钠溶液知识1:红色蓝色红色蓝色无色红色无色红色酸碱指示剂一.常见的酸1.几种常见的酸浓盐酸浓硫酸颜色、状态打开瓶盖后的现象气味露置于空气中无色、透明液体出现白雾(有挥发性)无色、粘稠状液体无味刺激性气味(酸味)无明显现象(不易挥发)干燥剂在实验室可以用浓硫酸做----浓硫酸具有吸水性,溶液质量变小,浓度减小(HCL挥发)溶液质量变大,浓度减小(吸水)2.浓硫酸的强腐蚀性—脱水性(碳化)实验放置一会儿后的现象用玻璃棒蘸浓硫酸在纸上写字用小木棍蘸少量浓硫酸把浓硫酸滴到一小块布上纸张由黄色变成黑色并穿洞变黑布会穿洞,并变成黑色归纳:浓硫酸的性质:(1)吸水性(作干燥剂)(2)强腐蚀性—脱水性(使物质碳化)课前五分钟1.胃酸中含有________,可以帮助消化.2.下列物质暴露在空气中,质量变大且浓度变小的是()A.NaOH固体B.浓硫酸C.浓盐酸D.稀硫酸3.一杯浓盐酸露天放置,它的浓度和质量有何变化?盐酸答:浓度变小,质量变小.B在稀释浓硫酸时,一定要把________沿器壁慢慢注入____里,并不断_______。切不可将______到进______.注意:浓硫酸水搅拌水酸浓硫酸的稀释:酸入水,沿内壁,缓慢倒,不断搅思考:顺序反了会怎样?-----液滴飞溅,伤人!3.酸的化学性质加紫色石蕊溶液加无色酚酞溶液稀盐酸稀硫酸红色红色无色无色(1)酸与指示剂的作用(2)酸与金属的反应----放出氢气与稀盐酸反应与稀硫酸的反应镁锌铁Mg+2HCl=H2+ZnCl2Mg+H2SO4=H2+MgSO4Zn+2HCl=H2+ZnCl2Zn+H2SO4=H2+ZnSO4Fe+2HCl=H2+FeCl2Fe+H2SO4=H2+FeSO4(3)酸与金属氧化物反应---生成盐和水现象化学方程式铁锈+盐酸铁锈+硫酸Fe2O3+6HCl=2FeCl3+3H2OFe2O3+3H2SO4=Fe2(SO4)3+3H2O铁锈逐渐消失,溶液由无色变黄色铁锈逐渐消失,溶液由无色变黄色讨论:•(1)上面反应的生成物有什么共同之处?•(2)利用上面的反应可以清除金属制品表面的锈,除锈时能否将金属制品长时间浸在酸中?为什么?((55))酸跟盐发生的反应酸跟盐发生的反应•已知鸡蛋壳的主要成分是碳酸钙,知识回忆已知鸡蛋壳的主要成分是碳酸钙,知识回忆↙↙+=实验室制取实验室制取COCO22CaCOCaCO33+2HCl=CaCl+2HCl=CaCl22+H+H22O+COO+CO22↑↑((44)酸跟碱发生的中和反应)酸跟碱发生的中和反应((44)酸跟碱发生的中和反应)酸跟碱发生的中和反应补充补充11:盐酸:盐酸跟硝酸银的反应跟硝酸银的反应现象现象分析分析有白色沉淀生成有白色沉淀生成AgNOAgNO33+HCl+HCl=AgCl=AgCl↓↓+HNO+HNO33实验步骤:实验步骤:在盛有少量稀盐酸的试管在盛有少量稀盐酸的试管中滴入几滴硝酸银溶液,观察现象。中滴入几滴硝酸银溶液,观察现象。补充补充22:硫酸:硫酸跟氯化钡的反应跟氯化钡的反应现象现象分析分析有白色沉淀生成有白色沉淀生成实验步骤:实验步骤:在盛有少量稀硫酸的试管中滴入几在盛有少量稀硫酸的试管中滴入几滴氯化钡的溶液,观察现象滴氯化钡的溶液,观察现象HH22SOSO44+BaCl+BaCl22=BaSO=BaSO44↓↓+2HCl+2HCl【【小结小结】】【【小结小结】】•11、、跟指示剂的反应跟指示剂的反应•22、、跟金属的反应跟金属的反应•33、、跟金属氧化物的反应跟金属氧化物的反应•44、、跟碱的中和反应跟碱的中和反应•55、、跟某些盐反应跟某些盐反应石蕊试液遇酸变成石蕊试液遇酸变成红色红色,,酚酞试液遇酸酚酞试液遇酸不变色不变色。。酸酸++金属金属====盐盐++氢气氢气↑↑Fe+2HCl=H2↑↑+FeCl2FeFe22OO33+6HCl=2FeCl+6HCl=2FeCl33+3H+3H22OO•金属氧化物金属氧化物++酸酸====盐盐++水水NaOH+HCl=NaCl+HNaOH+HCl=NaCl+H22OO酸酸++碱碱====盐盐++水水酸的化学性质酸的化学性质学完本节课,试归纳出酸有哪些相似的化学性质?课堂练习一.你会选吗?1.下列物质放入到稀硫酸中,无气体生成的是()A.铝B碳酸钠C铁锈D石灰石2.下列物质可由金属与发生置换反应得到的是()3.在实验室制备氢气可以用()A炭粒与水反应B铁屑与盐酸反应C锌粒与硝酸反应D铁屑与浓硫酸反应4.盐酸和稀硫酸常用作金属表面的清洁剂,是利用了它们化学性质中的()A能...