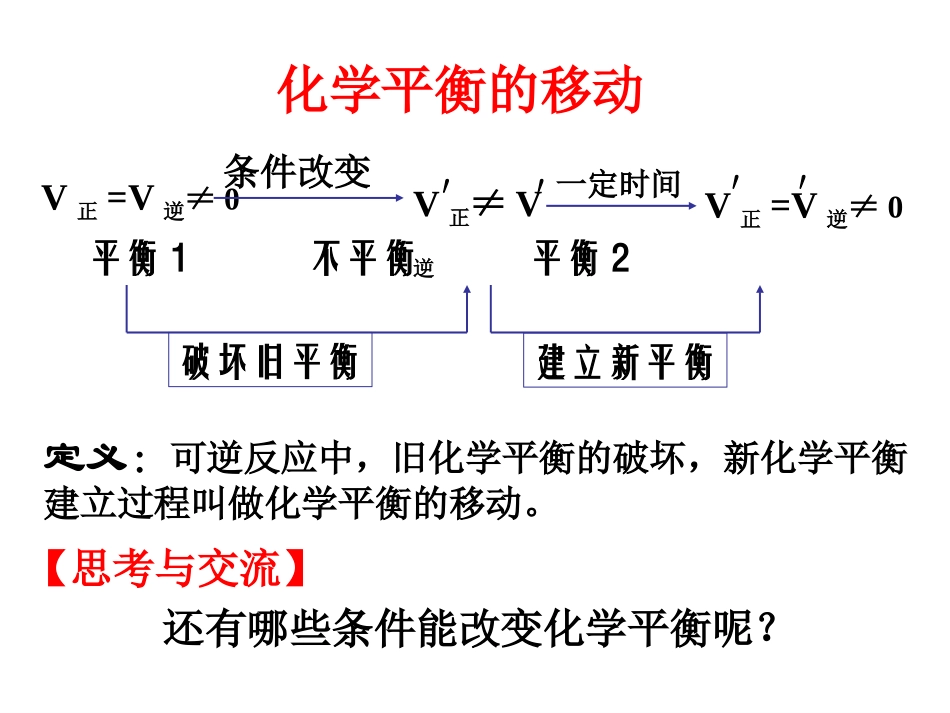
化学平衡的移动-温度对化学平衡的影响•2NO2(g)N2O4(g)H=-56.9kJ/mol△(红棕色)(无色)热水冰水常温结论:在其它条件不变的情况下,升高温度,平衡向着吸热反应方向移动;降低温度,平衡向着放热反应方向移动。定义:可逆反应中,旧化学平衡的破坏,新化学平衡建立过程叫做化学平衡的移动。V正≠V逆V正=V逆≠0条件改变平衡1不平衡平衡2建立新平衡破坏旧平衡V正=V逆≠0′′一定时间化学平衡的移动′′【思考与交流】还有哪些条件能改变化学平衡呢?在其他条件不变时,增大反应物或减小生成物的浓度化学平衡向正反应方向移动减小反应物或增大生成物的浓度化学平衡向逆反应方向移动向右移动向左移动原因分析:1、运用浓度对化学反应速率的影响以及化学平衡的建立等知识,解释浓度对化学平衡的影响2、运用平衡常数知识解释浓度对化学平衡的影响1、浓度对化学平衡的影响1、可逆反应C(s)+H2O(g)CO(g)+H2(g)在一定条件下达到平衡状态,改变下列条件,能否引起平衡移动?CO的浓度有何变化?①增大水蒸气浓度②加入更多的碳③增加H2浓度平衡正向移动,CO浓度增大平衡不移动,CO浓度不变平衡逆向移动,CO浓度减小解析:增加固体或纯液体的量不能改变其浓度,也不能改变速率,所以V(正)仍等于V(逆),平衡不移动。2、在一密闭容器中充入1molCO和1molH2O(g),在一定条件下发生反应CO(g)+H2O(g)=CO2+H2,达到平衡时生成2/3molCO2,当H2O改为4mol时,在上述条件下平衡时生成CO2的物质的量是:A0.6molB0.95molC1.0molD.2.5mol注意:⑴改变浓度一般通过改变物质的量来实现,但改变固体物质和纯液体的量,不影响平衡。⑵对于离子反应,只能改变实际参加反应的离子的浓度才能改变平衡。⑶对于一般的可逆反应(有两种反应物),增大一种反应物的浓度,会提高另一种反应物的转化率,而本身的转化率降低。⑷在生产上,往往采用增大容易取得或成本较低的反应物浓度的方法,使成本较高的原料得到充分的利用。2SO2+O22SO3反应特征改变条件改变条件的瞬间比较V正与V逆平衡移动反应物的转化率V正V逆气体或溶液中的反应适用增大CA减小CC增大CC反应特征改变条件改变条件的瞬间比较V正与V逆平衡移动反应物的转化率V正V逆正反应为放热升温降温正反应为吸热升温降温反应特征改变条件改变条件的瞬间比较V正与V逆平衡移动反应物的转化率V正V逆M+n=P+q加压减压对任一反应加入催化剂反应特征改变条件改变条件的瞬间比较V正与V逆平衡移动反应物的转化率V正V逆M+n>P+q加压减压M+n
P+q加压减压M+nP+q加压减压M+n