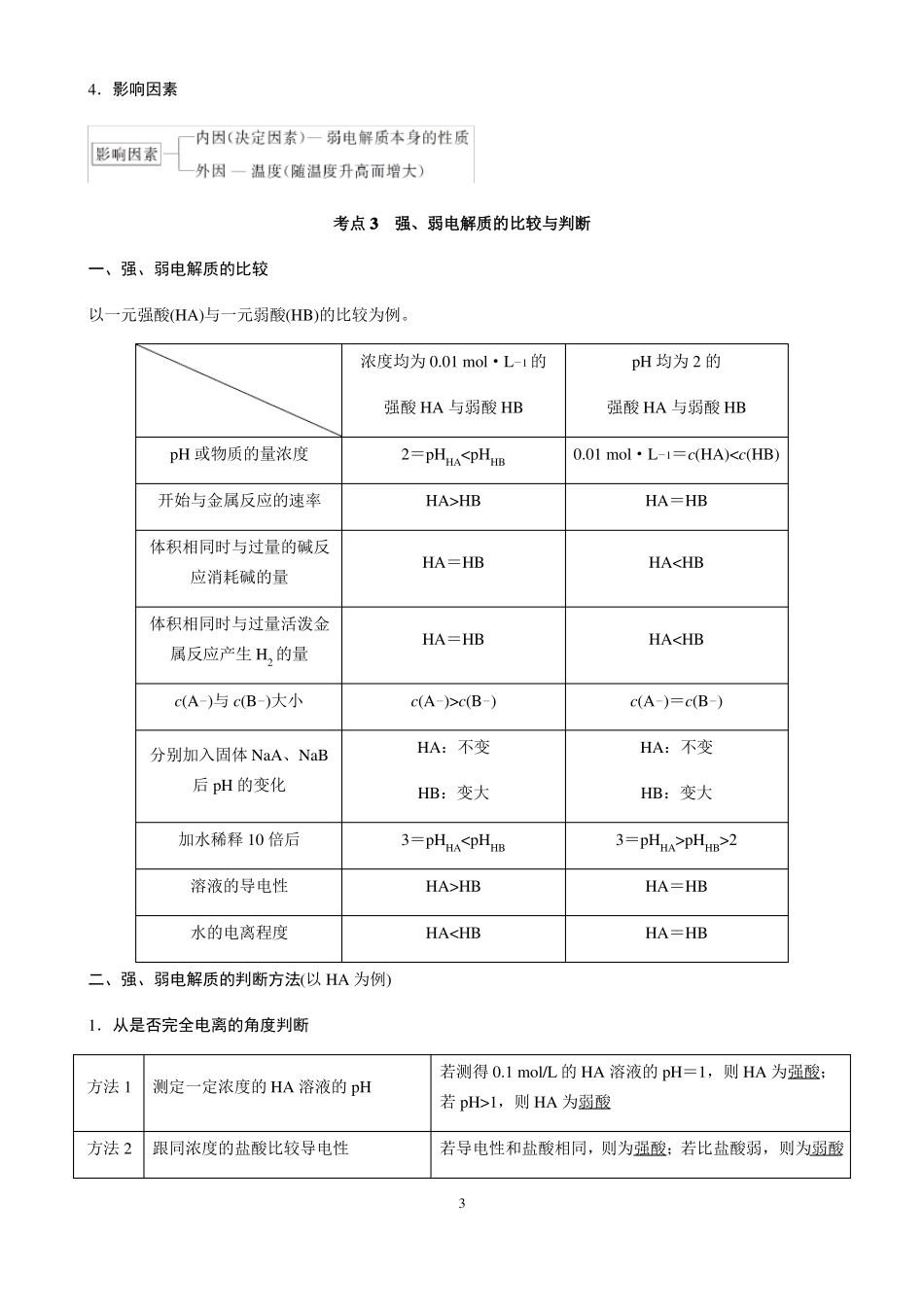
第八章水溶液中的离子平衡第一讲弱电解质的电离平衡考点1弱电解质的电离平衡一、弱电解质的电离平衡1.强、弱电解质(1)概念(2)与物质类别的关系①强电解质主要包括强酸、强碱和大多数盐。②弱电解质主要包括弱酸、弱碱、少数盐和水。(3)电离方程式的书写①弱电解质a.多元弱酸分步电离,且第一步电离程度远远大于第二步,如H2CO3电离方程式:H2CO3HCO3-H+HCO3,+-H+CO23。Fe3+3OH。+-+-b.多元弱碱电离方程式一步写成,如Fe(OH)3电离方程式:Fe(OH)3②酸式盐a.强酸的酸式盐完全电离,如NaHSO4电离方程式:NaHSO4===Na+H+SO24。b.弱酸的酸式盐中酸式酸根不能完全电离,如NaHCO3电离方程式:NaHCO3===Na+HCO3,HCO3H+CO23。2.电离平衡的建立在一定条件(如温度、浓度等)下,当弱电解质分子电离成离子的速率和离子结合成弱电解质分子的速率相等时,电离过程就达到平衡。平衡建立过程如图所示:+-+--++-13.电离平衡的特征二、影响电离平衡的外界条件1.温度:温度升高,电离平衡向右移动,电离程度增大。2.浓度:稀释溶液,电离平衡向右移动,电离程度增大。3.同离子效应:加入与弱电解质具有相同离子的强电解质,电离平衡向左移动,电离程度减小。4.加入能与电离出的离子反应的物质:电离平衡向右移动,电离程度增大。考点2电离平衡常数1.表达式(1)对于一元弱酸HA:HAc(H)·c(A)H+A,电离平衡常数K=。c(HA)+-+-(2)对于一元弱碱BOH:BOH2.特点c(B)·c(OH)B+OH,电离平衡常数K=。c(BOH)+-+-(1)电离平衡常数只与温度有关,因电离是吸热过程,所以升温,K值增大。(2)多元弱酸的各级电离平衡常数的大小关系是K1≫K2≫K3≫…,故其酸性取决于第一步。3.意义K值越大,说明弱电解质越易电离,其酸(碱)性越强。24.影响因素考点3强、弱电解质的比较与判断一、强、弱电解质的比较以一元强酸(HA)与一元弱酸(HB)的比较为例。浓度均为0.01mol·L强酸HA与弱酸HBpH或物质的量浓度开始与金属反应的速率体积相同时与过量的碱反应消耗碱的量体积相同时与过量活泼金属反应产生H2的量c(A)与c(B)大小分别加入固体NaA、NaB后pH的变化加水稀释10倍后溶液的导电性水的电离程度二、强、弱电解质的判断方法(以HA为例)1.从是否完全电离的角度判断若测得0.1mol/L的HA溶液的pH=1,则HA为强酸;若pH>1,则HA为弱酸若导电性和盐酸相同,则为强酸;若比盐酸弱,则为弱酸3---1的pH均为2的强酸HA与弱酸HB0.01mol·L1=c(HA)
HBHA=HBHAc(B)HA:不变HB:变大3=pHHAHBHApHHB>2HA=HBHA=HB--方法1测定一定浓度的HA溶液的pH方法2跟同浓度的盐酸比较导电性方法3跟同浓度的盐酸比较和锌反应的快慢若反应速率相同,则为强酸;若比盐酸慢,则为弱酸2.从是否存在电离平衡的角度判断(1)从一定pH的HA溶液稀释前后pH的变化判断如将pH=3的HA溶液稀释100倍后,再测其pH,若pH=5,则为强酸,若pH<5,则为弱酸。(2)从升高温度后pH的变化判断若升高温度,溶液的pH明显减小,则是弱酸。因为弱酸存在电离平衡,升高温度时,电离程度增大,c(H+)增大。而强酸不存在电离平衡,升高温度时,只有水的电离程度增大,pH变化幅度小。3.从酸根离子是否能发生水解的角度判断可直接测定NaA溶液的pH:若pH=7,则HA是强酸;若pH>7,则HA是弱酸。4第二讲水的电离和溶液的酸碱性考点1水的电离1.水的电离水是极弱的电解质,其电离方程式为2H2O2.水的离子积常数(1)表达式:Kw=c(H)·c(OH)。室温下,Kw=1×10+--14H3O+OH或H2O+-H+OH。+-。(2)影响因素:只与温度有关,水的电离是吸热过程,升高温度,Kw增大。(3)适用范围:Kw不仅适用于纯水,也适用于稀的电解质水溶液。在任何水溶液中均存在H和OH,只要温度不变,Kw不变。3.影响水的电离平衡的因素(1)升高温度,水的电离程度增大,Kw增大。(2)加入酸或碱,水的电离程度减小,Kw不变。(3)加入可水解的盐(如FeCl3、Na2CO3),水的电离程度增大,Kw不变。4.外界条件对水的电离平衡的影响体系变化平衡移动方向条件酸碱Na2...