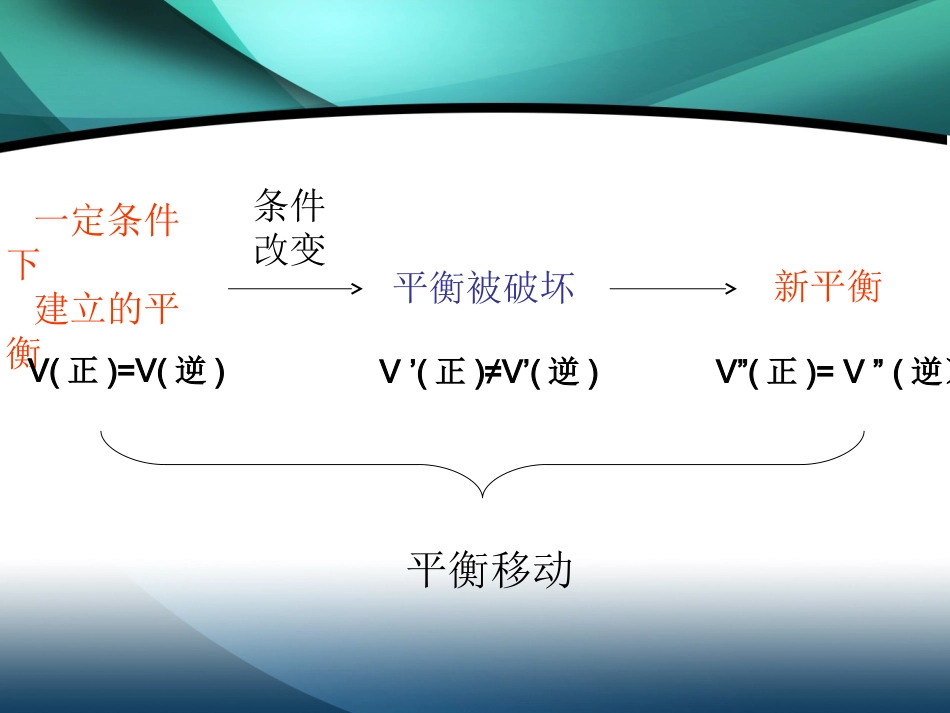
化学平衡的移动“逆”“等”“动”“定”“变”化学平衡的特点:——可逆反应——V正=V逆≠0——动态平衡——平衡时各组分的含量保持恒定——外界条件改变,平衡变化条件改变平衡移动一定条件下建立的平衡平衡被破坏新平衡V(正)=V(逆)V’(正)≠V’(逆)V”(正)=V”(逆)浓度温度压强催化剂【回忆】影响化学反应速率的外界条件主要有哪些?化学反应速率一、化学平衡的移动定义:改变外界条件,引起正、逆反应速率变化,破坏原有的平衡状态,建立起新的平衡状态的过程。研究对象:移动的本质原因:移动的标志:移动方向:已建立的化学平衡状态外界条件改变导致v正≠v逆混合物中各组分的含量发生改变v正>v逆v正<v逆v正=v逆平衡向正方向移动平衡向逆正方向移动平衡不移动二、化学平衡移动的影响因素1、浓度的变化对化学平衡的影响实验1ACr2O72-+H2O2CrO42-+2H+橙色黄色已知在K2Cr2O7的溶液中存在着如下平衡演示:(实验1)向试管中加入4ml0.1mol/LK2Cr2O7溶液;再滴加数滴1mol/LNaOH溶液,观察溶液颜色变化。(实验2)将上述溶液分成两分,向其中一份中滴加11mol/LHNO3溶液,观察溶液颜色变化,并和另一份溶液作对比。思考一:A组:1、试管中加入NaOH的目的是什么?改变了什么条件?2、试管中加入HNO3的目的是什么?改变了什么条件?说明:当其他条件不变时:增大反应物浓度,瞬间v正,v逆,v正v逆,随后v正逐渐,v逆逐渐,最终v正v逆,平衡向移动。增大不变减小增大>=正反应方向结论:结论:其它条件不变的情况下其它条件不变的情况下①①增大反应物浓度或减小生成物浓度平衡向正方向移动增大反应物浓度或减小生成物浓度平衡向正方向移动②②增大生成物浓度或减小反应物浓度平衡向逆方向移动增大生成物浓度或减小反应物浓度平衡向逆方向移动1、浓度的变化对化学平衡的影响结论t1v”正=v”逆V’逆V,正t2v正=v逆v正v逆t(s)v0平衡状态Ⅰ平衡状态Ⅱ用v-t图分析平衡移动增加反应物的浓度0vtV(正)V(逆)V’(正)V’(逆)v”正=v”逆减小反应物的浓度CO2(g)+C(s)2CO(g)t0vV(正)V(逆)V’(正)V’(逆)增大生成物的浓度0vtV(正)V(逆)V’(正)V’(逆)减小生成物的浓度想一想2、aA(aq)+bB(aq)cC(aq)+dD(aq)当a+b>c+d时,平衡后加水,平衡向哪里移动?1、对于CO2(g)+C(s)2CO(g),平衡后增加碳的质量,平衡是否移动?CO的浓度怎么变化?若平衡后在密闭容器中通入CO2,哪些物质浓度增大?平衡不移动,CO浓度不变。CO2、CO浓度增大V(正)、V(逆)都减小,但减小的程度不同,总的结果是化学平衡向反应方程式中化学计量数之和大的方向移动。Cr2O72-+H2O2CrO42-+2H+上述平衡C改变时,如何用Q来解释平衡移动的已知FeCl3+3KSCNFe(SCN)3+3KCl充分反应后,采取下列措施将会导致混合体系的颜色加深。A、向混合体系中加入FeCl3固体B、向混合体系中加入硫酸铁固体C、向混合体系中加入NaCl固体D、向混合体系中加KCl固体E、向混合体系中加入NH4SCNABE注意:①固体及纯液体的浓度是一定值,不因量的多少而改变,所以增加或减少固体及纯液体的量,不会影响平衡状态。②增加浓度导致v正和v逆最终都增大减小浓度导致v正和v逆最终都减小③离子反应中,只有真正参加反应的离子浓度的改变,化学平衡才能发生移动④反应物有2种或2种以上时,增加一种反应物的浓度,平衡右移,该物质的转化率降低,其他反应物的转化率大实验三2、压强对化学平衡的影响(红棕色)(无色)2NO2(气)N2O4(气)实验步骤:1、取一只装有NO2和N2O4混合气体的针管2、迅速挤压活塞,观察现象3、迅速拉动活塞,观察现象思考二1、改变压强对化学反应速率有什么影响?2、增大压强,该反应向哪个方向移动?减小压强呢?结论:结论:其它条件不变的情况下其它条件不变的情况下①①增大压强,会使平衡向着气体体积缩小的反增大压强,会使平衡向着气体体积缩小的反应方向移动;应方向移动;②②减少压强,会使平衡向着气体体积增大的反减少压强,会使平衡向着气体体积增大的反应方向移动应方向移动2、压强的变化对化学平衡的影响结论2NO2N2O4N2+3H22NH3FeO(s)+CO(g)Fe(s)+CO2(g)请写出上面反应在某温度下达到平衡的K表达式,在其他条件不变的情况下压缩体积...