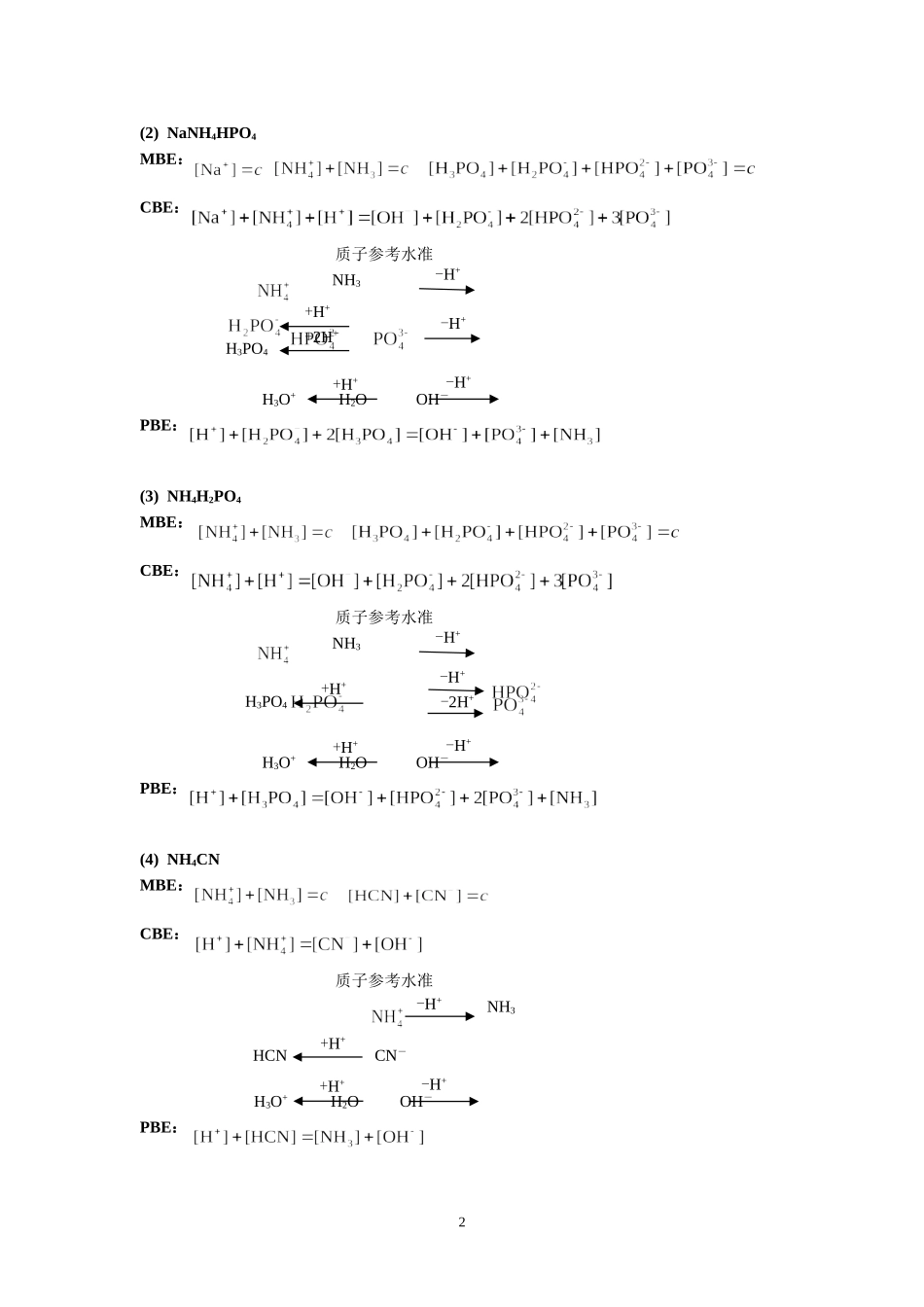
+第六章酸碱滴定法习题参考答案1.写出下列各酸的共轭碱H2O:OH-;H2C2O4:;;;C6H5OH:C6H5O-;:C6H5ONH2;HS-:S2-;:;2.写出下列各碱的共轭酸H2O:H3O+;;;S2-:HS-;C6H5O-:C6H5OH;:;(CH2)6N4:(CH2)6N4H+;;P2-:HP-3.通过MBE和CBE写出下列溶液的PBE(1)(NH4)2CO3MBE:CBE:PBE:(2)NH4HCO3MBE:CBE:PBE:4.写出下列物质的MBE、CBE和PBE(设定质子参考水准直接写出)(1)KHPMBE:CBE:质子参考水准H3O+H2OOH-PBE:1-H++H+H2P-H++H+P2-(2)NaNH4HPO4MBE:CBE:质子参考水准NH3H3O+H2OOH-PBE:(3)NH4H2PO4MBE:CBE:质子参考水准NH3H3O+H2OOH-PBE:(4)NH4CNMBE:CBE:质子参考水准NH3H3O+H2OOH-PBE:2-H+-H++H++2H+H3PO4-H++H+-H+-2H++H+H3PO4-H++H+-H++H+HCN-H++H+-H+CN-(5)(NH4)2HPO4MBE:CBE:质子参考水准NH3H3O+H2OOH-PBE:8.下列酸碱溶液浓度均为0.10mol/L,能否采用等浓度的滴定剂直接准确进行滴定?若能滴定,应选择什么标准溶液和指示剂?(1)HFKa=7.2×10-4根据判据cspKa=0.10×7.2×10-4=7.2×10-5>10-8,∴能采用等浓度的NaOH标准溶液直接准确滴定;化学计量点为0.050mol/L的NaF溶液。Kb=Kw/Ka=1.0×10-14/(7.2×10-4)=1.4×10-11cKb=0.050×1.4×10-11=7.0×10-13>20Kw,c/Kb=0.050/(1.4×10-11)>400pOH=6.07pH=7.92∴选择酚酞指示剂。(5)NaHCO3∴不能采用等浓度的NaOH标准溶液直接准确滴定。∴能采用等浓度的HCl标准溶液直接准确滴定;化学计量点为0.040mol/L的H2CO3溶液。pH=3.89∴选择甲基橙指示剂。(6)(CH2)6N4cspKb=0.050×1.4×10-9=7×10-11<10-8,∴不能采用等浓度的HCl标准溶液直接准确滴定。(7)(CH2)6N4·HCl3-H+-H++H++2H+H3PO4-H++H+Ka=Kw/Kb=1.0×10-14/(1.4×10-9)=7.1×10-6cspKa=0.050×7.1×10-6=3.6×10-7>10-8,∴能采用等浓度的NaOH标准溶液直接准确滴定;化学计量点为0.050mol/L的(CH2)6N4溶液。cKb=0.050×7.1×10-6=3.6×10-7>20Kw,c/Kb=0.050/(7.1×10-6)>400pOH=5.08pH=8.92∴选择酚酞指示剂。9.强酸(碱)滴定一元弱酸(碱),cspKa(Kb)≥10-8就可以直接准确滴定。如果用Kt表示滴定反应的形成常数,那么该反应的cspKt应为多少?答:cspKa(Kb)=cspKwKt=csp10-14Kt≥10-8∴cspKt≥10610.为什么一般都用强酸(碱)溶液作酸(碱)标准溶液?为什么酸(碱)标准溶液的浓度不宜太浓或太稀?答:强酸(碱)反应的完全程度大,滴定突跃较大,选择指示剂范围大。若酸(碱)标准溶液的浓度太浓,计量点后过量半滴或一滴引起的误差大;若浓度太稀,滴定突跃不明显,误差也大。11.下列多元酸(碱)、混合酸(碱)溶液中每种酸(碱)的分析浓度均为0.10mol/L(标明的除外),能否用等浓度的滴定剂准确进行分步滴定或分别滴定?若能直接滴定(包括滴总量),根据计算的pHsp选择适宜的指示剂?(2)H2C2O4∴不能分步滴定。∴可以用等浓度的NaOH标准溶液直接准确滴定总量;化学计量点为0.033mol/L的Na2C2O4溶液。=1.0×10-14/(6.4×10-5)=1.6×10-10=1.0×10-14/(5.9×10-2)=1.7×10-13pOH=5.64pH=8.36∴选择酚酞指示剂。(6)联氨4∴能分步滴定。∴可以用等浓度的HCl标准溶液直接准确滴定至第一化学计量点,产物为0.050mol/L的溶液。=0.050×7.6×10-15<20Kwc=0.050>pOH=9.10pH=4.90∴选择甲基红指示剂。12.HCl和HAc的混合溶液(浓度均为0.10mol/L),能否以甲基橙为指示剂,用0.1000mol/LNaOH直接准确滴定其中的HCl?此时有多少HAc参与了反应(用δHAc表示)?答:不能直接准确滴定其中的HCl,因为HAc的cspKa=0.05×1.8×10-5>10-8,HAc也能被滴定。若滴定至甲基橙由红色变为黄色为终点,这时溶液pH约为4.4,参与反应的δHAc即为15.解:(1)根据题意得:V2=5.00mL(2)根据题意得:V2=40.00mL或者: ∴NaHCO3和NaOH反应后V2=40.00mL(3)根据题意得:只含有NaOH18.计算下列溶液的pH值(1)2.0×10-7mol/LHCl解:c<10-6mol/LpH=6.62(2)0.020mol/LH2SO4解:5pH=1.59(3)0.10mol/LNH4Cl(NH3的Kb=1.8×10-5)解:Ka=Kw/Kb=1.0×10-14/(1.8×10-5)=5.6×10-10cKa=0.10×5.6×10-10=5.6×10-11>...