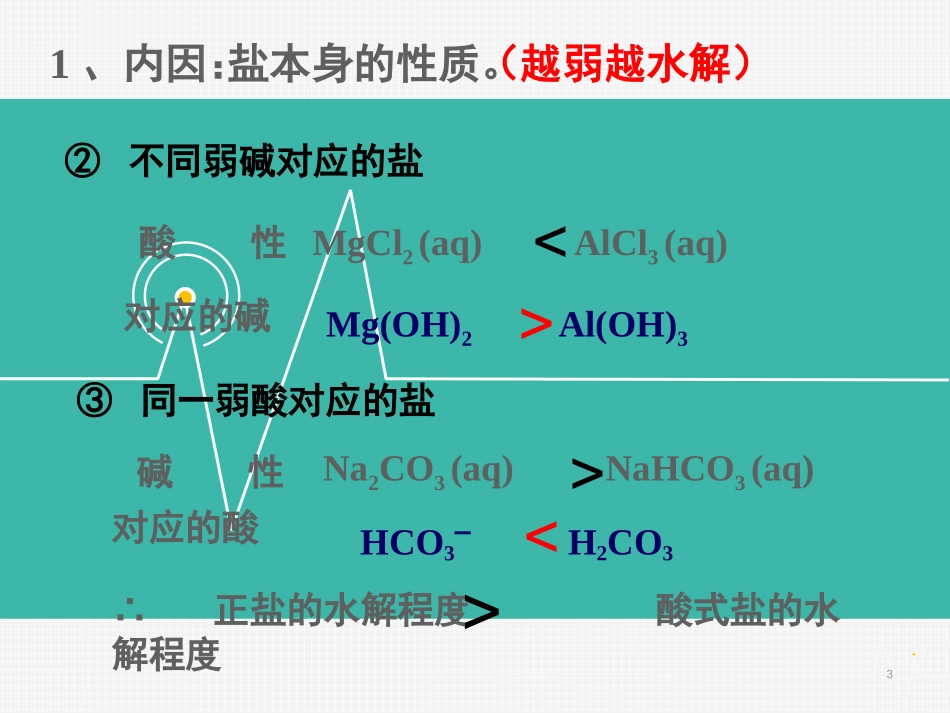
第3章水溶液中的离子平衡第三节盐类水解第2课时影响盐类水解的因素盐类水解平衡影响因素在一定条件下,当盐类的水解生成酸和碱的速率和酸和碱发生中和反应的速率相等时,达到水解平衡。1、内因:盐本身的性质。(越弱越水解)NaClO(aq)CH3COONa(aq)对应的酸HClOCH3COOH<>碱性1、内因:盐本身的性质。(越弱越水解)③同一弱酸对应的盐Na2CO3(aq)NaHCO3(aq)对应的酸HCO3–H2CO3<>碱性∴正盐的水解程度酸式盐的水解程度>MgCl2(aq)AlCl3(aq)②不同弱碱对应的盐对应的碱酸性Mg(OH)2Al(OH)3<>32、外因:①温度:升温,促进水解。(越热越水解)②浓度:加水稀释,促进水解。(越稀越水解)③溶液的酸碱性:配制FeCl3溶液需要注意什么问题?加入一定量的,抑制FeCl3的水解。Fe3++3H2OFe(OH)3+3H+HCl对于水解平衡CH3COO–+H2OCH3COOH+OH–改变条件方向c(Ac–)c(HAc)c(OH–)c(H+)pH水解程度升温加H2O加醋酸加醋酸钠通HCl(g)加NaOH25℃时,在浓度为1mol·L-1的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的溶液中,测得c(NH4+)分别为a、b、c(单位为mol·L-1)。下列判断正确的是()A.a=b=cB.a>b>cC.a>c>bD.c>a>bD【课堂练习】