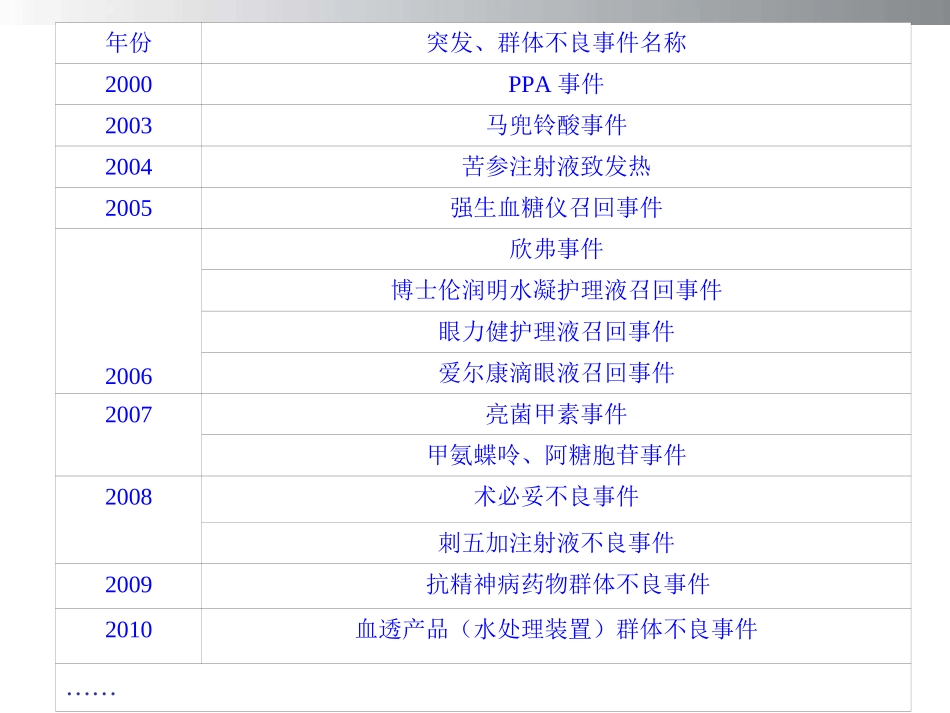
药械突发、群体不良事件调查处置工作方法年份突发、群体不良事件名称2000PPA事件2003马兜铃酸事件2004苦参注射液致发热2005强生血糖仪召回事件2006欣弗事件博士伦润明水凝护理液召回事件眼力健护理液召回事件爱尔康滴眼液召回事件2007亮菌甲素事件甲氨蝶呤、阿糖胞苷事件2008术必妥不良事件刺五加注射液不良事件2009抗精神病药物群体不良事件2010血透产品(水处理装置)群体不良事件……主要内容工作职责与程序定义、分级及适用范围目的法规依据主要内容工作职责与程序定义、分级及适用范围目的法规依据1.法规依据1《药品不良反应报告和监测管理办法》(卫生部令第81号)4《医疗器械不良事件监测与再评价管理办法》(国食药监械[2008]766号)5《医疗器械不良事件监测工作指南》(国食药监械[2011]425号)3《药品和医疗器械安全突发事件应急预案(试行)》(国食药监办[2011]370号)2《药品和医疗器械突发性群体不良事件应急预案》(国食药监办[2005]329号)•《药品不良反应报告和监测管理办法》(27-32条)(卫生部令第81号)••••••••第27条药品生产、经营企业和医疗机构获知或者发现药品群体不良事件后,应当立即通过电话或者传真等方式报所在地的县级药品监督管理部门、卫生行政部门和药品不良反应监测机构,必要时可以越级报告;同时填写《药品群体不良事件基本信息表》,对每一病例还应当及时填写《药品不良反应/事件报告表》,通过国家药品不良反应监测信息网络报告。第28条设区的市级、县级药品监督管理部门获知药品群体不良事件后,应当立即与同级卫生行政部门联合组织开展现场调查,并及时将调查结果逐级报至省级药品监督管理部门和卫生行政部门。第29条药品生产企业获知药品群体不良事件后应当立即开展调查,详细了解药品群体不良事件的发生、药品使用、患者诊治以及药品生产、储存、流通、既往类似不良事件等情况,在7日内完成调查报告,报所在地省级药品监督管理部门和药品不良反应监测机构;同时迅速开展自查,分析事件发生的原因,必要时应当暂停生产、销售、使用和召回相关药品,并报所在地省级药品监督管理部门。第30条药品经营企业发现药品群体不良事件应当立即告知药品生产企业,同时迅速开展自查,必要时应当暂停药品的销售,并协助药品生产企业采取相关控制措施。第31条医疗机构发现药品群体不良事件后应当积极救治患者,迅速开展临床调查,分析事件发生的原因,必要时可采取暂停药品的使用等紧急措施。第32条药品监督管理部门可以采取暂停生产、销售、使用或者召回药品等控制措施。卫生行政部门应当采取措施积极组织救治患者。1.法规依据1《药品不良反应报告和监测管理办法》(卫生部令第81号)4《医疗器械不良事件监测与再评价管理办法》(国食药监械[2008]766号)5《医疗器械不良事件监测工作指南》(国食药监械[2011]425号)3《药品和医疗器械安全突发事件应急预案(试行)》(国食药监办[2011]370号)2《药品和医疗器械突发性群体不良事件应急预案》(国食药监办[2005]329号)•《医疗器械不良事件监测与再评价管理办法》(20条)(国食药监械[2008]766号)第20条医疗器械生产企业、经营企业和使用单位发现突发、群发的医疗器械不良事件,应当立即向所在地省、自治区、直辖市食品药品监督管理部门、卫生主管部门和医疗器械不良事件监测技术机构报告,并在24小时内填写并报送《可疑医疗器械不良事件报告表》。医疗器械生产企业、经营企业和使用单位认为必要时,可以越级报告,但是应当及时告知被越过的所在地省、自治区、直辖市食品药品监督管理部门、卫生主管部门和医疗器械不良事件监测技术机构。1.法规依据1《药品不良反应报告和监测管理办法》(卫生部令第81号)4《医疗器械不良事件监测与再评价管理办法》(国食药监械[2008]766号)5《医疗器械不良事件监测工作指南》(国食药监械[2011]425号)3《药品和医疗器械安全突发事件应急预案(试行)》(国食药监办[2011]370号)2《药品和医疗器械突发性群体不良事件应急预案》(国食药监办[2005]329号)1.法规依据《药品管理法》《突发事件应对法》《国家突发公共事件总体应急预案》《国家突发公共卫...