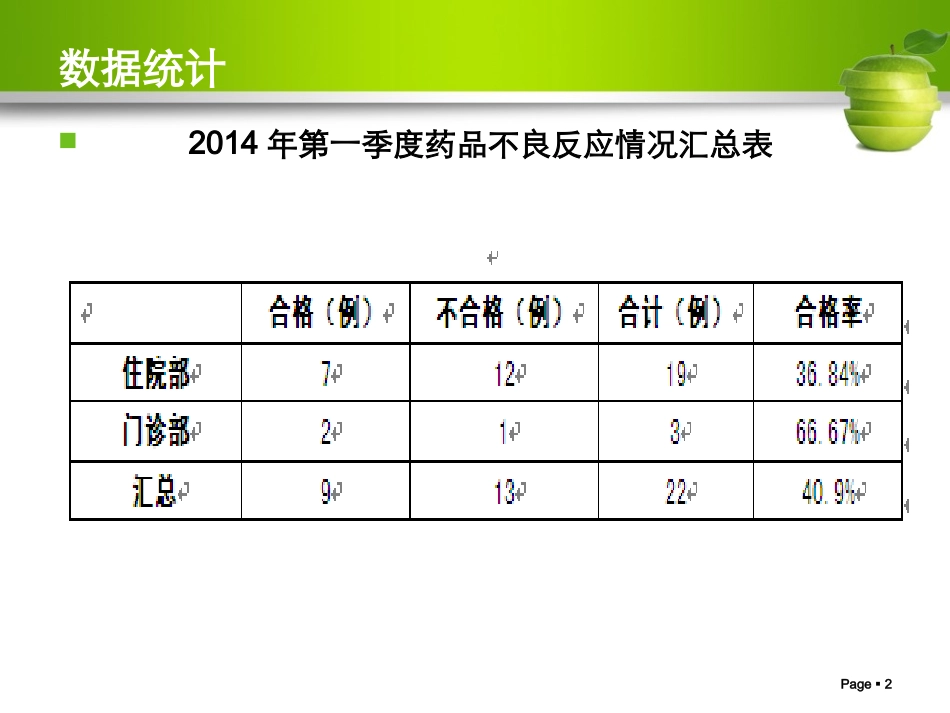
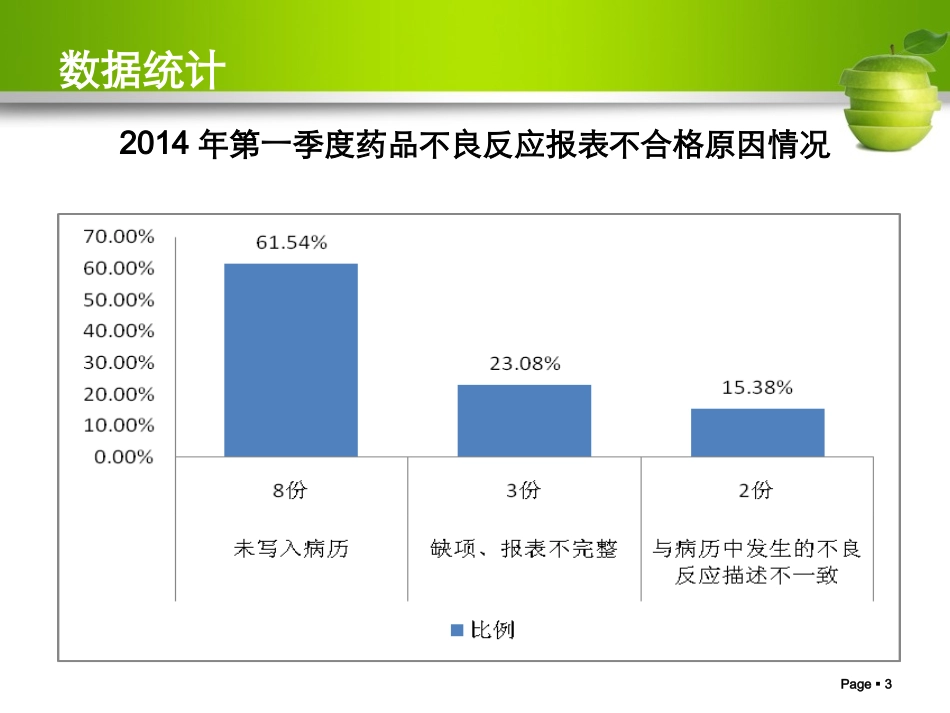
1药品不良反应上报及常见问题Page2数据统计2014年第一季度药品不良反应情况汇总表Page3数据统计2014年第一季度药品不良反应报表不合格原因情况Page4Page4目录药品不良反应监测基础知识药品不良反应报告要求我院不良反应监测及上报流程Page5统计数据根据WHO统计:全球每年住院患者中就有10%~20%发生药品不良反应,其中,5%因严重ADR而死亡Page6一、药品不良反应基础知识基本概念基本概念药品不良反应(药品不良反应(ADR)ADR)药品不良事件(药品不良事件(ADE)ADE)群体不良事件群体不良事件新的药品不良反应新的药品不良反应药品严重不良反应药品严重不良反应//事件事件Page7基本概念药品不良反应(ADR—AdverseDrugReaction)指合格药品在正常用法用量下出现的与用药目的无关的或意外的有害反应。Page8基本概念ADR概念所表达的涵义合格药品(合法生产、经营、储存,符合法定质量标准)正常使用(符合说明书要求)一般剂量(常规剂量)与治疗目的无关(非预期的疗效)意外的有害反应(上市前未被发现)Page9基本概念1、A类药品不良反应(量变异常型)由于药品本身的药理作用的增强而发生的,常与剂量和合并用药有关。多数能预测、发生率较高、死亡率较低。2、B类药品不良反应(质变异常型)与药品正常药理作用完全无关的异常反应。分为药物异常性、病人异常性。难预测、发生率低、死亡率高。3、C类药品不良反应(迟现性不良反应)如:三致Page10基本概念要明确ADR≠假、劣药ADR≠用药差错ADR≠医疗事故Page11基本概念药品不良事件(ADE-AdverseDrugEvent)药品不良事件(ADE):指药物在临床治疗过程中所发生的不良临床事件,该事件并非一定与用药有因果关系。Page12药品不良反应与药品不良事件区别项目药品不良反应药品不良事件药品质量合格药品合格药品和(或)不合格药品用法用量正常用法、正常剂量不强调与用法、剂量的关系用药行为排除了意向性和意外性过量用药与用药不当的行为不排除意向性和意外性过量用药与用药不当行为因果关系药品与不良反应有因果关系药品与不良事件未必有因果关系风险责任不属于医疗纠纷,不承担赔偿责任误用、滥用、使用不合格药品等的后果因医方导致,属医疗纠纷并承担相应责任Page13基本概念药品群体不良事件是指同一药品(指同一生产企业生产的同一药品名称、同一剂型、同一规格的药品)在使用过程中,在相对集中的时间、区域内,对一定数量人群的身体健康或者生命安全造成损害或者威胁,需要予以紧急处置的事件。Page14基本概念新的药品不良反应药品使用说明书中未载明的不良反应。说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。Page15基本概念严重药品不良反应药品严重不良反应药品严重不良反应//事件事件导致死亡危及生命致癌、致畸、致出生缺陷导致显著的或者永久的人体伤残或者器官功能的损伤导致住院或住院时间延长导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。Page16药物不良反应产生的原因(一)药物方面(二)机体方面(三)用药方面药物相互作用:用药种类越多发生率越高。合用药物数(种)不良反应发生率(%)2-56-1011-1516-20>204.27.424.24045Page17正确认识ADR只要是药品,就存在不良反应只要使用药品,就存在发生不良反应的风险Page18不良事件各级关系药品不良反应药害事件药品安全(不良)事件医疗安全(不良)事件Page19二、药品不良反应报告要求Page20如何开展药品不良反应报告与监测在用药过程中,若发生了可疑不良反应,怎么办?我们要报告如何报告?向谁报告?Page21报告原则可疑即报您认为可疑药品不良反应/事件请尽快报告!Page22报告时限死亡病例严重的或新的一般的及时报告15日之内30日之内Page23报表组成患者信息1药品信息2事件过程3评价4Page24Page25患者信息Page26药品信息Page27药品信息并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。1.不良反应发生时,患者同时使用的其他药品2.并用药品的信息可能提...