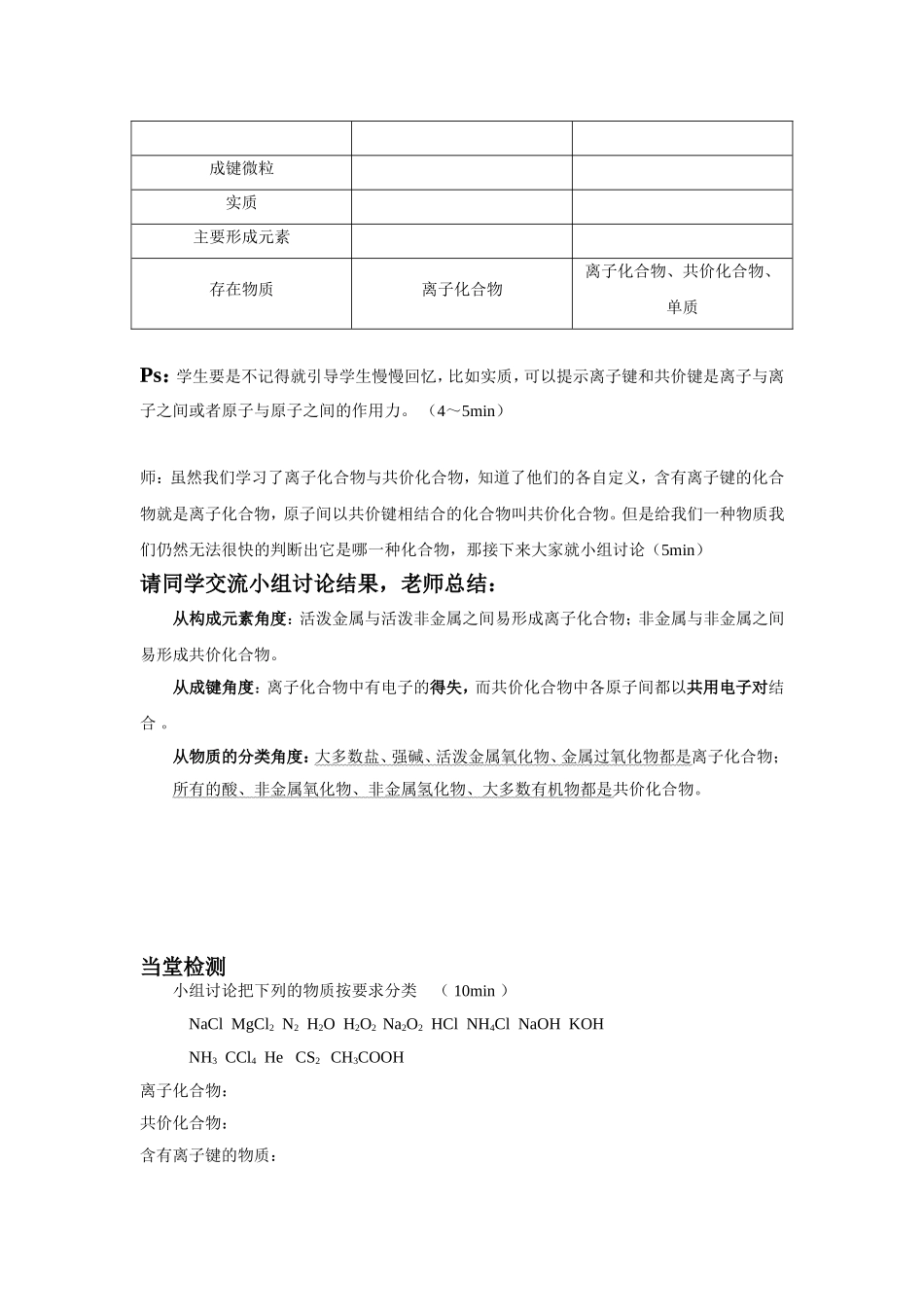
化学键复习课(导学案)一、教学目标思路与方法1、通过练习让学生对前面学习的电子式进行巩固;2、利用比较法来让学生掌握离子键和共价键的不同;3、利用比较法来让学生更容易对离子化合物和共价化合物进行判断。重点1、离子键和共价键判断方法;2、离子化合物与共价化合物判断方法。难点离子键与离子化合物,共价键与共价化合物的关系与区别。二、教学过程课前练习1、写出下列原子的电子式NaCOF2、写出下列离子化合物的电子式NaClMgCl2Na2S3、写出下列共价化合物或共价单质的电子式,并写出其结构式N2H2OCS2Ps:教师可以让学生演版,也可以让学生在下面做,教师观察学生做题速度和时间,时间控制在5~8min。做完后让学生对照自己做的注意以下事项:1、简单阳离子用离子符号表示:如Na+、Mg2+。2、简单阴离子用[]表示并标明离子的电子数和所带电荷数:[]2-师:离子键与共价键的定义我们都很熟悉了,那接下来我们一起对比着看看他们的区别离子键共价键成键微粒实质主要形成元素存在物质离子化合物离子化合物、共价化合物、单质Ps:学生要是不记得就引导学生慢慢回忆,比如实质,可以提示离子键和共价键是离子与离子之间或者原子与原子之间的作用力。(4~5min)师:虽然我们学习了离子化合物与共价化合物,知道了他们的各自定义,含有离子键的化合物就是离子化合物,原子间以共价键相结合的化合物叫共价化合物。但是给我们一种物质我们仍然无法很快的判断出它是哪一种化合物,那接下来大家就小组讨论(5min)请同学交流小组讨论结果,老师总结:从构成元素角度:活泼金属与活泼非金属之间易形成离子化合物;非金属与非金属之间易形成共价化合物。从成键角度:离子化合物中有电子的得失,而共价化合物中各原子间都以共用电子对结合。从物质的分类角度:大多数盐、强碱、活泼金属氧化物、金属过氧化物都是离子化合物;所有的酸、非金属氧化物、非金属氢化物、大多数有机物都是共价化合物。当堂检测小组讨论把下列的物质按要求分类(10min)NaClMgCl2N2H2OH2O2Na2O2HClNH4ClNaOHKOHNH3CCl4HeCS2CH3COOH离子化合物:共价化合物:含有离子键的物质:含有共价键的物质:Ps:做完订正后让同学们对比着观察四栏所选物质,引导学生发现如下规律:1、离子键只存在离子化合物中,不存在共价化合物中。2、离子化合物中一定存在离子键,也有可能含有共价键(NH4ClNa2O2KOH)。3、共价化合物中一定含有共价键且一定不含共价键。4、共价键可能存在单质、离子化合物和共价化合物中。